Électrophorèse sur gel de polyacrylamide
L'électrophorèse sur gel de polyacrylamide ou PAGE est une application de l'électrophorèse de zone, elle est particulièrement utilisée pour l'étude des protéines ou pour le séquençage de l'ADN.

Catégories :
Biologie moléculaire - Technique de biologie moléculaire - Électrophorèse - Chimie analytique
Recherche sur Google Images :
Source image : ead.univ-angers.fr Cette image est un résultat de recherche de Google Image. Elle est peut-être réduite par rapport à l'originale et/ou protégée par des droits d'auteur. |
Page(s) en rapport avec ce sujet :
- L'électrophorèse sur gel de polyacrylamide est une bonne technique pour le fractionnement des protéines comparé d'autres techniques comme la séparation... (source : memoireonline)
- En vue d'une séparation par électrophorèse sur gel polyacrylamide, ... à 100° en présence de SDS puis l'électrophorèse sur gel de polyacrylamide est réalisée.... Le SDS a la propriété de charger toutes mes protéines présentes dans le ... (source : e-sante.futura-sciences)
- L'électrophorèse sur gel de polyacrylamide est ..... séparer les complexes des ADN libres. Quelle que soit la méthode utilisée le «signal»... (source : tel.archives-ouvertes)
L'électrophorèse sur gel de polyacrylamide ou PAGE (acronyme de l'anglais poly-acrylamide gel electrophoresis) est une application de l'électrophorèse de zone, elle est particulièrement utilisée pour l'étude des protéines ou pour le séquençage de l'ADN.
Utilisation
Un gel de polyacrylamide est une matrice de séparation utilisée en électrophorèse de biomolécules, telles que les protéines ou les fragments d'ADN. Les techniques respectant les traditions de séquençage de l'ADN telles que les méthodes de Maxam-Gilbert ou de Sanger utilisent les gels de polyacrylamide pour séparer des fragments d'ADN : ceux-ci possèdent un pouvoir résolutif de 1 paire de bases. Une autre méthode de séparation de l'ADN utilise l'électrophorèse en gels d'agarose, mais n'est cependant pas adaptée à la séparation de petits fragments.
La méthode PAGE est aujourd'hui la méthode la plus utilisée en immunologie et en analyse des protéines, pour visualiser différentes protéines scindées en bandes différentes selon leur poids moléculaire. Celles-ci peuvent alors être transférées sur membrane de nitrocellulose ou de PVDF pour être mises en contact avec des anticorps spécifiques. Cette technique se nomme le Western blot.
Composition
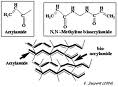
Les gels de polyacrylamide peuvent fluctuer en composition. Ils sont constitués d'acrylamide qui est l'unité de base et de bisacrylamide (N, N methylène-bisacrylamide) qui est l'agent pontant. Suivant les différents taux de ces deux substances on obtient différents maillages et par conséquent différentes densités de gel. La réaction de polymérisation se fait grâce à l'ajout de deux substances réactives : le "TEMED" et "l'ammonium persulfate" qui, en réagissant avec la lumière, deviennent des anions hyper réactifs enclenchant la polymérisation.
Des niveaux supérieurs de polymérisation aboutissent à une structure de gel plus dense, ce qui permet une meilleure séparation des protéines. Des niveaux plus bas minimisent la rétention des protéines, mais sont fréquemment requis pour séparer des protéines de poids moléculaires proches. Ces gels sont utilisés pour évaluer visuellement le poids moléculaire des protéines comparé à celui de protéines connues.
Gels de séparation
Typiquement les gels de séparation sont faits à 6%, 8%, 10%, 12% ou 15%. Un gel de concentration (stacking gel) (5%) est coulé en haut du gel de séparation pour permettre une entrée homogène de l'échantillon dans le gel de séparation. Des pistes individuelles sont réalisées par l'utilisation d'un "peigne" qui sépare le gel en portions identiques conçues pour la migration de chaque échantillon. Le pourcentage choisi dépend de la taille de la protéine qu'on veut identifier ou de la sonde dans l'échantillon. Plus le poids connu est petit, plus le pourcentage devra être élevé.
Préparation
Les mélanges ci-dessous ne polymériseront pas tant que le TEMED n'aura pas été ajouté, mais si elle est stockée de façon non polymérisée assez longtemps, le mélange peut ne pas polymériser correctement. La taille standard du gel est de 3x5x0.2 pouces, et en tenant compte des fuites qui se produisent le plus souvent, il faut environ 8 ml de solution pour un gel de séparation et 2 ml pour un gel de concentration. Pour les longues migrations, ou des longs temps d'exposition aux champs électriques, il convient d'immerger entièrement le gel dans un bain de solution afin d'éviter la déshydratation du gel à la limite positive dut à la migration des molécules d'eau dans le champ électrique.
Pour préparer 10 ml d'une solution mère à 10% de polyacrylamide (en séparation)
(Comme pour toute solution biologique, l'eau est plutôt distillée et désionisée - en abrévié, ddH2O)
| Composant | Volume |
|---|---|
| ddH20 | 4, 0 ml |
| mélange d'acrylamide 30% | 3, 3 ml |
| 1, 5M Tris pH 8.8 | 2, 5 ml |
| 10% SDS | 0, 1 ml |
| 10% ammonium persulfate | 0, 1 ml |
| TEMED | 0, 004 ml |
Pour préparer 10 ml d'une solution mère à 5% de polyacrylamide (stacking)
(notez que les volumes sont les mêmes que ci-dessus, seule la concentration en Tris fluctue) :
| Composant | Volume |
|---|---|
| ddH20 | 4, 0 ml |
| mélange à 30% d'acrylamide | 3, 3 ml |
| 1, 0M Tris pH 6.8 | 2, 5 ml |
| 10% SDS | 0, 1 ml |
| 10% ammonium persulfate | 0, 1 ml |
| TEMED | 0, 004 ml |
Cependant, de tels volumes de stacking gel sont rarement nécessaires en pratique.
A titre d'exemple, pour examiner approximativement 15 échantillons, on préfère en fabriquer 4 ml. Les volumes nécessaires donnés sont en ce cas :
| Composant | Volume |
|---|---|
| ddH20 | 2, 7 ml |
| mélange à 30% d'acrylamide | 0, 67 ml |
| 1, 0M Tris pH 6.8 | 0, 5 ml |
| 10% SDS | 0, 04 ml |
| 10% ammonium persulfate | 0, 04 ml |
| TEMED | 0, 004 ml |
Précaution d'emploi
L'acrylamide en poudre ou à l'état liquide est extrêmement toxique, en particulier pour le dispositif nerveux, quand il est ingéré, et est absorbé particulièrement aisément par la peau, d'où l'obligation de prendre des précautions lors de la manipulation.
En revanche, l'acrylamide une fois polymérisé n'est plus absorbable, mais il faut tout de même prendre soin de la façon dont on se débarrasse du gel.
Voir aussi
Recherche sur Amazone (livres) : |
Voir la liste des contributeurs.
La version présentée ici à été extraite depuis cette source le 30/11/2010.
Ce texte est disponible sous les termes de la licence de documentation libre GNU (GFDL).
La liste des définitions proposées en tête de page est une sélection parmi les résultats obtenus à l'aide de la commande "define:" de Google.
Cette page fait partie du projet Wikibis.

 Accueil
Accueil Recherche
Recherche Début page
Début page Contact
Contact Imprimer
Imprimer Accessibilité
Accessibilité