Ion
Un ion est un atome, ou un groupe d'atomes, qui a perdu sa neutralité électrique suite à l'acquisition ou à la perte d'un ou de plusieurs électrons.
Définitions :
- Atome ayant perdu ou gagné des électrons sur sa couche externe; Molécule portant une charge négative ou positive, du fait qu'un de ses atomes ait perdu ou gagné des électrons sur sa couche externe (source : fr.wiktionary)
- un ion est une particule chargée électriquement. Certains atomes peuvent se lier les uns les autres ioniquement pour former des molécules. Certains atomes sont autorisés à avoir certaines charges ioniques ainsi ils peuvent se lier avec d'autres atomes ayant des charges ioniques opposées. (source : fr.wikibooks)
- Atome ou groupe d'atomes ayant gagné ou perdu un ou plusieurs électrons. (source : pagesperso-orange)
Un ion est un atome, ou un groupe d'atomes, qui a perdu sa neutralité électrique suite à l'acquisition ou à la perte d'un ou de plusieurs électrons.
Il en résulte qu'un ion est une espèce chimique électriquement chargée.
Le terme provient de l'anglais, à partir de l'adjectif grec ἰόν (ion), se traduisant par «allant, qui va»[1].
La valeur de cette charge est indiquée en exposant à la fin de la formule chimique de l'ion, en multiple de la charge électrique élémentaire e.
Histoire
Le nom «ion» a été donné, vers 1830, par Michæl Faraday, aux espèces chimiques responsables de la conductivité électrique des liquides. Il fallut attendre 1885 pour que le suédois Svante August Arrhenius propose une explication du mécanisme de conduction, pour lequel il sera récompensé par le prix Nobel de chimie en 1903.
Des faisceaux d'ions de haute énergie sont utilisés en physique atomique, physique nucléaire et physique des particules (voir accélérateur de particules). Des faisceaux de basse énergie sont utilisés dans l'analyse des surfaces (voir SIMS).
Classification des ions
Les ions sont caractérisés par :
- La nature de leur charge :
- Cations : Ions chargés positivement
- Anions : Ions chargés négativement
- Zwitterions : Ions possédant en même temps des charges positives et négatives : Acides aminés...
- Le nombre d'atomes qui les composent :
- Monoatomiques : Ions constitués d'un seul atome
- Polyatomiques : Ions constitués de plusieurs atomes.
- Leur dépendance du pH :
- Ions forts : Totalement dissociés quel que soit le pH :
- Anions : Sulfonate, Sulfate, halogénures…
- Cations : Ammonium quaternaire, Na+, K+, Mg2+, Ca2+ …
- Ions faibles : Dissociation partielle dépendante du pH :
- Anions : Carboxylate...
- Cations : Ammoniums tertiaire, secondaire et primaire...
- Ions forts : Totalement dissociés quel que soit le pH :
D'où la classification suivante des ions :
- Cations monoatomiques : Ce sont des ions métalliques. Pour un même élément, les suffixes "eux" et "ique" sont utilisés. Le suffixe "ique" indique l'ion qui a la charge la plus élevée :
- Cations polyatomiques : Ce sont des ions non-métalliques. Ils sont le plus souvent des sels d'onium obtenus par alkylation d'hétéroatomes :
- Ammoniums, pyridinium, phosphoniums, sulfoniums...
- Anions monoatomiques : Ils sont le plus souvent obtenus par déprotonation d'hydracides :
- Anions polyatomiques : Ils sont le plus souvent obtenus par déprotonation d'oxacides. Pour les oxacides, les préfixes "hypo" et "per" et les suffixes "eux" et "ique" sont utilisés. Le préfixe'hypo" et le suffixe "eux" indiquent les ions qui ont le nombre d'oxygène le plus faible. Les oxacides en "eux" deviennent des ions "ite" et les oxacides en "ique" deviennent des ions "ate" :
- Hypochlorite
- Nitrite, phosphorite, chlorite, bromite
- Nitrate NO3-, sulfonate, sulfate SO42-, phosphate, phosphonates, chlorate, bromate, iodate, acétate, tosylate, triflate, carboxylates, carbonate, bicarbonate
- Perchlorate...
Solides ioniques
Ces solides sont constitués d'un empilement alterné de cations et d'anions reliés par des liaisons dites «ioniques» ; la cohésion de la totalité est assurée par les forces électrostatiques. A titre d'exemple, le sel de table (chlorure de sodium) est un empilement d'ions chlorure et d'ions sodium.
Ces solides sont aisément solubles dans l'eau ou d'autres solvants polaires, car les ions y sont aisément solvatés (dispersés parmi les molécules du solvant).
Les solutions ioniques
Un liquide contenant des ions parmi le solvant est nommé solution ionique. Dans la solution, les ions se déplacent aisément sous l'effet d'un champ électrique, d'où la forte conductibilité électrique des solutions ioniques. La mesure de la conductivité électrique d'une solution (conductimétrie) permet par conséquent d'estimer sa teneur globale en ions. Une solution ionique est électriquement neutre.
Ainsi, l'eau des océans, qui forment principale réserve hydrique de la Terre, est riche en ions :
| Concentration approximative des principaux ions dans l'eau de mer normale | ||||||||||
| Ions | Cl− | Na+ | SO42– | Mg2+ | Ca2+ | HCO3− | Br− | CO32− | Sr2+ | F– |
| mg·L−1 | 19 000 | 11 000 | 2 700 | 1 300 | 420 | 110 | 73 | 15 | 8, 1 | 1, 3 |
La quantité de matière d'une espèce d'ions dans un volume de solution est nommé concentration molaire de cette espèce d'ions. Si S est la solution et X l'espèce d'ions, la concentration molaire est donnée par la relation :
![[X]=\frac{n_X}{V_S}](illustrations/5fd61c3474592109ac8534b005b0cf91.png) d'où
d'où ![[X]=\frac{m_X}{V_S \times M_X}](illustrations/353c0abeed078839ca909a4d1902d12a.png)
Cependant, dans le langage familier, on utilise d'avantage la concentration massique, donnée par la relation :
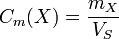
Ionisation de composés moléculaires
Dans certains corps moléculaires, certains atomes attirent plus les électrons de liaisons que d'autres. On dit tandis que les liaisons entre atomes sont polarisées. Au contact d'un solvant polaire, comme l'eau, les molécules de ces composés tel l'acide sulfurique, l'ammoniac ou le dioxyde de carbone, se dissocient en ions au cours de la dissolution.
Électroneutralité
Tout composé chimique étant électriquement neutre, s'il contient des ions, il contient alors obligatoirement à la fois des cations et des anions, dans des proportions telles que la charge positive des cations compense précisément la charge négative des anions. Cette propriété est valable pour les solides comme pour les solutions ioniques.
Exemple : le chlorure de calcium solide est constitué d'ions calcium Ca2+ et d'ions chlorure Cl−. La charge d'un ion calcium vaut +2e (2 charges élémentaires, alors que celle d'un ion chlorure vaut -e ; pour que la totalité soit neutre, les proportions des ions sont par conséquent de 2 ions chlorure pour 1 ion calcium. La formule ionique de ce sel est par conséquent (Ca2+, 2 Cl−), sa formule statistique CaCl2.
Ions négatifs et ioniseurs
Les appareils générateur d'ions négatifs ont pour nom : «ioniseurs».
Ils sont commercialisés en magasin ou sur Internet pour la majorité, sous prétexte que les «ions négatifs» permettraient «d'assainir l'air ambiant». Il faut employer le mot ioniseur et non "ionisateur".
Vendu jusqu'à 750 euros pour les plus gros, le prix n'a que peu de rapport avec l'efficacité ou l'utilité du produit. En France ainsi qu'aux États-Unis, certains appareils furent à plusieurs reprises interdits de publicité car mensongère et non fondée sur des recherches ou études scientifiques sérieuses.
Au début les ioniseurs étaient «mal vu» car ils pouvaient générer de l'ozone, mais depuis plusieurs années les fabricants proposent des ioniseurs de plus en plus performants et avec une génération faible d'ozone. Pour tout autant aucun effet positif sur la santé humaine n'a pu être scientifiquement établi.
Notes et références
- Le petit Larousse illustré, édition 2009, p. 551, ISBN 978-2-03-584070-7
- Le petit Larousse illustré, édition 2009, p. 551, ISBN 978-2-03-584070-7
Recherche sur Google Images : |
|
"IONS ET SOLUTIONS IONIQUES" L'image ci-contre est extraite du site physiquechimie.blog4ever.com Il est possible que cette image soit réduite par rapport à l'originale. Elle est peut-être protégée par des droits d'auteur. Voir l'image en taille réelle (1004 × 383 - 48 ko - jpg)Refaire la recherche sur Google Images |
Recherche sur Amazone (livres) : |
Voir la liste des contributeurs.
La version présentée ici à été extraite depuis cette source le 30/11/2010.
Ce texte est disponible sous les termes de la licence de documentation libre GNU (GFDL).
La liste des définitions proposées en tête de page est une sélection parmi les résultats obtenus à l'aide de la commande "define:" de Google.
Cette page fait partie du projet Wikibis.


 Accueil
Accueil Recherche
Recherche Début page
Début page Contact
Contact Imprimer
Imprimer Accessibilité
Accessibilité