Détermination de l'indice d'acide
L'indice d'acide d'un corps gras est la quantité de potasse en mg indispensable pour neutraliser son acidité libre. La teneur en acides libres des corps gras augmente avec le temps : l'indice d'acide permet par conséquent de juger de leur état de détérioration.
L'indice d'acide d'un corps gras est la quantité de potasse en mg indispensable pour neutraliser son acidité libre. La teneur en acides libres des corps gras augmente avec le temps : l'indice d'acide permet par conséquent de juger de leur état de détérioration.
Principe
L'indice d'acide est déterminé par un dosage en retour. Le corps gras réagit avec un excès connu de potasse alcoolique. L'excès de potasse est alors dosé par une solution d'acide chlorhydrique. Le corps gras est mis en solution par un solvant organique neutre.
Protocole
1- Étalonnage de la solution de HCl par pesée de borax (Chcl=0.1 mol/l) :
- peser précisément une masse approcger à 300 mg de borax
- chauffer un peu pour solubiliser tout le borax (Mborax=381.22g/mol)
- ajouter 20ml d'eau + 5 gouttes de vert de bromocrésol
- réaliser le dosage de la solution de HCl positionnée dans la burette jusqu'à avoir 2Chcl à 2CV (CV=0.01)
2- Dosage de la solution d'acide gras
- 10 mL de potasse éthanoïque de concentration C=0.1mol/l
- 5 mL d'acide gras
- 2 gouttes de phénolphtaléine
3- Réalisation du témoin
- 10 mL de potasse
- 5 mL de solvant organique
- 2 gouttes de phénolphtaléine
Matériel
- Béchers
- burette
- pipette jaugée de 10 mL
Solutions
- potasse alcoolique (KOH, OH) de concentration 0, 1 mol/L
- acide chlorhydrique de concentration 0, 1 mol/L précisément connue
- phénolphtaléine
- éthanol
Étapes
Préparation de la solution de corps gras
Les corps gras étant insolubles dans l'eau, il faut les dissoudre dans un solvant.
- Dans un bécher, peser une masse connue et voisine de 4 g d'échantillon.
- Ajouter 100 mL de solvant.
- Agiter pour dissoudre le corps gras.
Dosage de l'indice d'acide
- Dans un bécher, introduire 10mL de solution de l'échantillon.
- Ajouter 10mL de potasse alcoolique de concentration 0, 1 mol/L.
- Ajouter 2 à 4 gouttes de phénolphtaléine.
- Doser l'excès de potasse par l'acide chlorhydrique de concentration 0, 1 mol/L en agitant constamment jusqu'au virage de l'indicateur à l'incolore.
- Faire deux essais.
Réalisation des témoins
Comme la concentration de la potasse alcoolique n'est pas connue, on la détermine au moyen d'un témoin.
- Dans un bécher, introduire 10 mL de potasse alcoolique et 10 mL de solvant mais aussi 2 ou 3 gouttes de phénolphtaléine.
- Titrer avec l'acide jusqu'au virage de l'indicateur à l'incolore.
Équation des réactions
Le dosage est un dosage acide/base en retour, pour plus d'information se reporter à l'article sur le pH.
- Réaction entre les acides gras (monoacide organique) et l'hydroxyde de potassium
Cette réaction se déroule lorsque l'acide gras et la potasse sont en contact. L'acide gras libère un ion H`+ qui est capté par les ions OH- (provenant de KOH).
- Réaction entre un acide gras (monoacide organique) et l'hydroxyde de potassium
- Cette réaction se déroule lors du dosage du témoin et de l'excès de KOH dans la solution d'échantillon.
Calculs
Concentration de la potasse alcoolique
Une mole de OH − réagit avec une mole de H3O +.
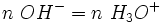 .
.
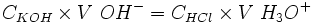 .
.
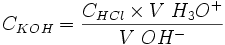 .
.
Indice d'acide
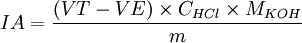
- IA : indice d'acide
- VT : volume de solution d'acide chlorhydrique utilisé pour le témoin en mL.
- VE : volume de solution d'acide chlorhydrique utilisé la solution d'échantillon.
- CHCL : concentration d'acide chlorhydrique donnée.
- MKOH : masse molaire du KOH en g/mol.
- m : masse d'huile précisément pesée en mg.
Si l'acide gras est pur, on peut déterminer sa masse molaire :
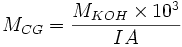
Précisions / Sécurité
Ne rien jeter dans l'évier, les solvants organiques sont dangereux pour l'environnement. Manipuler les solvants sous hotte ventilée avec la protection adaptée (gants et lunettes de protection). Pour plus de détails sur la sécurité, se reporter à l'étiquetage des produits. Vous pouvez conserver la solution d'acide gras pour la Détermination de l'indice de saponification
Voir aussi
Recherche sur Google Images : |
"Et l'indice d'acide d'un" L'image ci-contre est extraite du site comlive.net Il est possible que cette image soit réduite par rapport à l'originale. Elle est peut-être protégée par des droits d'auteur. Voir l'image en taille réelle (113 × 49 - 1 ko - png)Refaire la recherche sur Google Images |
Recherche sur Amazone (livres) : |
Voir la liste des contributeurs.
La version présentée ici à été extraite depuis cette source le 30/11/2010.
Ce texte est disponible sous les termes de la licence de documentation libre GNU (GFDL).
La liste des définitions proposées en tête de page est une sélection parmi les résultats obtenus à l'aide de la commande "define:" de Google.
Cette page fait partie du projet Wikibis.


 Accueil
Accueil Recherche
Recherche Début page
Début page Contact
Contact Imprimer
Imprimer Accessibilité
Accessibilité