Solution
Une solution est un mélange homogène de deux ou plusieurs substances, originellement dans un état.
Définitions :
- Liquide homogène contenant un corps dissout - préparation diluée de certains produits odorants ou de concentrés de Parfum (solution alcoolique). (source : beautissimo)
Une solution est un mélange homogène de deux ou plusieurs substances, originellement dans un état (solide, liquide, gazeux).
La substance majoritaire est nommée solvant, les substances minoritaires sont les solutés.
Solution dans un gaz
On parle assez rarement de «solution» pour un gaz. Un mélange de gaz est généralement homogène après un court instant, à cause de l'agitation thermique (voir les articles Mouvement brownien et Diffusion), mais il peut y avoir une stratification en présence d'un champ de gravité si la hauteur du contenant est importante...
Solution dans un liquide
La solution dans un liquide est l'exemple le plus connu. Une solution ayant l'eau comme solvant est nommée solution aqueuse. Il est envisageable de mettre en solution :
- un liquide dans un autre : limité par la miscibilité des deux liquides.
- un solide dans un liquide : limité par la solubilité du solide dans le solvant, au delà de laquelle le solide n'est plus dissous. On parle alors de solution saturée.
- un gaz dans un liquide.
La concentration massique, noté "t" (ou "Cm") donne l'expression c=m/V La concentration molaire, noté "C" (ou "Cn") donne l'expression C=n/V
Solution solide
Une solution solide correspond à un solide homogène constitué par le mélange de plusieurs corps purs.
Cœxistence de phases
Une solution peut être
- saturée : à une température et une pression données, une solution saturée est une solution qui ne peut plus dissoudre de soluté ;
- insaturée : une solution insaturée est une solution qui peut dissoudre plus de soluté, aux conditions du dispositif ;
- sursaturée : une solution sursaturée est une solution contenant une plus grande quantité de soluté dissous que celle qui correspond à la limite de saturation.
Proportion de phases et concentration
Soient l composants. La concentration du composant peut s'exprimer de plusieurs manières :
- la fraction molaire Ni (sans unité ou %mol), qui est le rapport entre le nombre ni de moles de i sur le nombre n total de moles
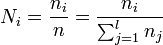 ;
; - le pourcentage massique Mi (sans unité ou %m), qui est le rapport entre la masse mi de i sur la masse totale m
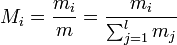 .
.
Dans le cas d'une solution liquide, on se ramène fréquemment à un volume d'un litre de solution, et on définit :
- la concentration molaire Ci (mol·L-1), rapport entre le nombre de moles de i et le volume de liquide
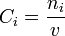 ;
; - la concentration massique τi, rapport entre la masse de i et le volume de liquide
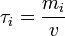 ;
; - le pourcentage volumique Vi (%vol) : dans le cas d'un mélange de liquides, c'est le volume vi de i divisé par le volume total v
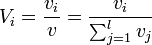 .
.
Dans le cas d'un gaz, on utilise
- la pression partielle pi, qui est la contribution de la phase i à la pression ;
- le pourcentage volumique (sans unité ou %vol), qui est , dans les conditions de pression et de température fixées, le volume vi que représenterait la phase i toute seule sur le volume total ; dans le cas de gaz parfaits, on montre facilement que le pourcentage volumique est égale à la pression partielle divisée par la pression totale p
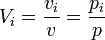 .
.
Solution diluée, activité
On nomme une solution diluée le cas d'une solution pour laquelle la quantité de solutés est particulièrement inférieure à la quantité totale de solution. Si on sert à désigner le solvant par l'indice s, on peut par conséquent utiliser les approximations suivantes :
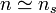 ,
, 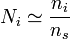 ,
, 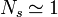 ;
;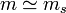 ,
, 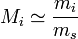 ,
, 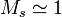 .
.
Pour les solutions liquides :
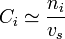 , Cs est l'inverse du volume molaire du solvant ;
, Cs est l'inverse du volume molaire du solvant ;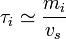 , τs' est la masse volumique du solvant ;
, τs' est la masse volumique du solvant ;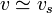 ,
, 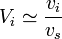 ,
, 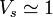
Dans le cas d'une solution diluée, le potentiel chimique est une fonction affine du logarithme de la concentration, pour une température fixée :
- en solution liquide,
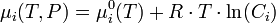 , Ci étant exprimé en mol·L-1 ;
, Ci étant exprimé en mol·L-1 ; - en solution gazeuse,
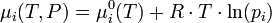 , pi étant exprimé en atmosphère.
, pi étant exprimé en atmosphère.
Quand on n'est plus en solution diluée (ou dans le cas de gaz, à haute pression, quand on ne peut plus faire l'approximation des gaz parfaits), il faut faire intervenir l'activité chimique ai :
- dans le cas d'une solution liquide, ai = γi·Ci où γi est le cœfficient d'activité de i ;
- dans le cas d'une solution gazeuse, ai = ƒi·pi où ƒi est la fugacité.
Ceci est l'approche du point de vue «chimique» : on part de ce qu'on mesure bien (le volume, la masse…). D'un point de vue thermodynamique, on débute plutôt par définir l'activité, puis on établit que dans le cas des solutions diluées,
- pour un liquide, l'activité d'un soluté vaut environ sa concentration molaire (liquide) et l'activité du solvant vaut 1 ;
- pour un gaz, l'activité du soluté est pression partielle en atmosphère, un gaz ayant une pression partielle d'une atmosphère a une activité de 1 ;
- pour un solide, l'activité vaut 1.
Voir aussi
Recherche sur Google Images : |

"Solutions de marque : FLOXAL" L'image ci-contre est extraite du site usinenouvelle.com Il est possible que cette image soit réduite par rapport à l'originale. Elle est peut-être protégée par des droits d'auteur. Voir l'image en taille réelle (637 × 467 - 27 ko - jpg)Refaire la recherche sur Google Images |
Recherche sur Amazone (livres) : |
Voir la liste des contributeurs.
La version présentée ici à été extraite depuis cette source le 30/11/2010.
Ce texte est disponible sous les termes de la licence de documentation libre GNU (GFDL).
La liste des définitions proposées en tête de page est une sélection parmi les résultats obtenus à l'aide de la commande "define:" de Google.
Cette page fait partie du projet Wikibis.


 Accueil
Accueil Recherche
Recherche Début page
Début page Contact
Contact Imprimer
Imprimer Accessibilité
Accessibilité