Acide carboxylique
Le terme acide carboxylique sert à désigner une molécule comprenant un groupement carboxyle OH). Ce sont des acides et leurs bases conjuguées sont nommées carboxylates.
Recherche sur Google Images :

Source image : unspf.fr Cette image est un résultat de recherche de Google Image. Elle est peut-être réduite par rapport à l'originale et/ou protégée par des droits d'auteur. |
Page(s) en rapport avec ce sujet :
- Les acides gras : des acides comme l'acide octadécanoïque (stéarique) ou octadéc -9-ènoïque (oléïque) sont nommés acides gras. Ils entrent en effet dans la... (source : pedagogie.ac-montpellier)
- ... Alors voilà la question : on veut identifier un acide carboxylique de type R-COOH, qui contient un atome de brome. La masse de l'acide RCOOH... (source : forums.futura-sciences)
Le terme acide carboxylique sert à désigner une molécule comprenant un groupement carboxyle (–C (O) OH). Ce sont des acides et leurs bases conjuguées sont nommées carboxylates.
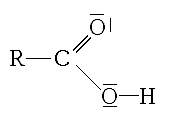
En chimie organique, un groupe carboxyle est un groupe fonctionnel composé d'un atome de carbone, lié par une double liaison à un atome d'oxygène et lié par une liaison simple à un groupe hydroxyle.
Généralités
En chimie, les acides carboxyliques R-COOH forment avec les acides sulfoniques R-SO3H les deux types d'acides de la chimie organique. On les trouve de manière abondante dans la nature, sous la forme d'acide gras (lipide) et ils sont particulièrement importants en chimie industrielle. A titre d'exemple, l'acide acétique est non seulement une brique importante pour les molécules complexes qu'on trouve en biologie, mais est aussi une molécule produite industriellement et qu'on retrouve dans le vinaigre. Un des plus connus est l'acide acétylsalicylique, plus connu sous le nom d'aspirine. La brique de base des protéines, les acides aminés sont des acides carboxyliques.
Le groupe fonctionnel caractéristique est le groupe carboxyle, ou R est un hydrogène ou un groupe organique :
Les acides carboxyliques ont pour formule brute CnH2nO2 quand le R est un groupe alkyle. Le calcul du nombre d'insaturation donne : 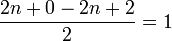 . Cette insaturation traduit la liaison double carbone-oxygène.
. Cette insaturation traduit la liaison double carbone-oxygène.
On écrit fréquemment les groupements carboxyles sous la forme réduite : -COOH (forme non ionisée du groupement). La forme ionisée du groupement est : -COO-.
Ce dernier est toujours localisé en fin de chaîne carbonée. L'ajout d'un groupement carboxyle à un composé organique est une carboxylation, l'élimination de ce même groupement est une décarboxylation.
Ions carboxylates
Ce sont les bases conjuguées des acides carboxyliques. Ces bases sont généralement plutôt faibles. La charge négative sur la molécule est délocalisée sur les deux atomes d'oxygène du groupe carboxyle par mésomérie, ce qui explique la stabilité relative de ce type de molécules.
Nomenclature
- Systématique : on ajoute le suffixe «-oïque» au nom de l'alcane correspondant (ayant le même nombre d'atomes de carbone), et en le faisant précéder de "acide".
- Usuelle : comme de nombreux composés organiques, les acides carboxyliques ont des noms usuels souvent utilisés dans la littérature et rappelant la source depuis laquelle ils furent en premier lieu isolés. Cependant une liste définie par l'IUPAC règle l'usage des noms triviaux acceptés aux côtés des noms systématiques[1].
| Type | Structure | Nom IUPAC | nom commun | Source | |
|---|---|---|---|---|---|
| Monoacides aliphatiques | |||||
| H-COOH | acide méthanoïque | acide formique | Sécrété par certaines fourmis (latin : formica, fourmis) | ||
| CH3-COOH | acide éthanoïque | acide acétique | latin : acetum, vinaigre | ||
| CH3CH2-COOH | acide propanoïque | acide propionique | grec : pion, gras | ||
| CH3 (CH2) 2-COOH | acide butanoïque | acide butyrique | grec : bouturos, beurre | ||
| CH3 (CH2) 3-COOH | acide pentanoïque | acide valérique | valériane | ||
| CH3 (CH2) 4-COOH | acide hexanoïque | acide caproïque | |||
| CH3 (CH2) 5-COOH | acide heptanoïque | acide énanthique | |||
| CH3 (CH2) 6-COOH | acide octanoïque | acide caprylique | noix de coco, lait maternel | ||
| CH3 (CH2) 7-COOH | acide nonanoïque | acide pélargonique | |||
| CH3 (CH2) 8-COOH | acide décanoïque | acide caprique | |||
| CH3 (CH2) 9-COOH | acide undécylique | ||||
| CH3 (CH2) 10-COOH | acide dodécanoïque | acide laurique | huile de noix de coco | ||
| CH3 (CH2) 11-COOH | acide tridécylique | ||||
| CH3 (CH2) 12-COOH | acide tétradécanoïque | acide myristique | |||
| CH3 (CH2) 13-COOH | acide pentadecylique | ||||
| CH3 (CH2) 14-COOH | acide hexadécanoïque | acide palmitique | huile de palme | ||
| CH3 (CH2) 15-COOH | |||||
| CH3 (CH2) 16-COOH | acide octodécanoïque | acide stéarique | graisses animales | ||
| CH3 (CH2) 17-COOH | |||||
| CH3 (CH2) 18-COOH | acide éicosanoïque | acide arachidique | huile d'arachide, les huiles de poisson et les huiles végétales. | ||
| CH3 (CH2) 20-COOH | |||||
| Monoacides aromatiques | |||||
| C6H5-COOH | acide benzoïque | benzène | |||
| HO-C6H4-COOH | acide 2-hydroxybenzoïque | acide salicylique | fruits (sous forme de salicylate de méthyle) | ||
| Diacides aliphatiques | |||||
| HOOC-COOH | acide éthanedioïque | acide oxalique | présent dans énormément d'aliments comme l'oseille (latin : oxalis) ou les épinards | ||
| HOOC-CH2-COOH | acide 1, 3-propanedioïque | acide malonique | |||
| HOOC-CH2-CH2-COOH | acide 1, 4-butanedioïque | acide succinique | |||
| HOOC-CH2-CH2-CH2-COOH | acide 1, 5-pentanedioïque | acide glutarique | |||
| HOOC- (CH2) 4-COOH | acide 1, 6-hexanedioïque | acide adipique | monomère du nylon | ||
| HOOC- (CH2) 5-COOH | acide 1, 7-heptanedioïque | ||||
| HOOC- (CH2) 6-COOH | acide 1, 8-octanedioïque | ||||
| HOOC- (CH2) 7-COOH | acide 1, 9-nonanedioïque | acide azélaïque | |||
| HOOC- (CH2) 8-COOH | acide 1, 10-décanedioïque | ||||
| HOOC- (CH2) 9-COOH | acide 1, 11-undecanedioïque | ||||
| HOOC- (CH2) 10-COOH | acide 1, 12-dodécanedioïque | ||||
| Diacides aromatiques | |||||
| C6H4 (COOH) 2 | acide phtalique | ||||
| C6H4 (COOH) 2 | benzène-1, 3-dicarboxylique | acide isophtalique | |||
| C6H4 (COOH) 2 | acide benzène-1, 4-dicarboxylique ou acide paraphtalique | acide téréphtalique | |||
| Acides alpha hydroxylés | |||||
| CH2 (OH) -COOH | acide hydroxyacétique | acide glycolique | canne à sucre, betteraves, raisin. | ||
| CH3CH (OH) -COOH | acide 2-hydroxypropanoïque | acide lactique | latin : lac, lactis, lait | ||
| HOOC-CH2-CH (OH) -COOH | acide 2-hydroxy-1, 4-butanedioïque | acide malique | pomme (latin : malus) | ||
| HOOC-CH (OH) -CH (OH) -COOH | acide 2, 3-dihydroxybutanedioïque | acide tartrique | Vin | ||
| HOOC-CH2- (COOH) C (OH) -CH2-COOH | acide 2-hydroxypropane-1, 2, 3-tricarboxylique | acide citrique | citron | ||
| Acides thiols | |||||
| CH3CH (SH) -COOH | acide 2-mercaptopropanoïque | acide thiolactique |
NB : un moyen mnémotechnique pour se souvenir des noms des diacides linéaires, dans l'ordre croissant du nombre de carbones, est la phrase suivante : "On Mange Saucisse Grillée A Point" (Oxalique, Malonique, Succinique, Glutarique, Adipique, Pimélique). Les diacides sont utilisés pour la synthèse de polyamides et de polyesters.
D'autres types d'acides carboxyliques peuvent être cités : les cétoacides, les acides aminés et les acides gras.
Propriétés physiques et structurelles
État
Les acides carboxyliques sont liquides dans les conditions normales tant que leur chaine carbonée présente moins de 8 atomes de carbone. Ils sont solides au-delà.
Les acides de faible masse molaire possèdent une forte odeur ; par exemple l'acide butanoïque est responsable de l'odeur du beurre rance.
Polarité, solubilité
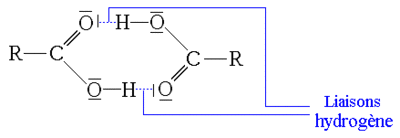
La fonction acide carboxylique est fortement polaire et est à la fois donneur et accepteur de liaisons hydrogène. Ceci permet la création de liaisons hydrogène par exemple avec un solvant polaire comme l'eau, l'alcool, et d'autres acides carboxyliques.
De par cette propriété les acides carboxyliques de petite taille (jusqu'à l'acide butanoïque) sont totalement solubles dans l'eau. Les molécules d'acides sont aussi capables de former des dimères stables par pont hydrogène, ce qui permet d'expliquer pourquoi leur température d'ébullition est plus élevée que celle des alcools correspondants.
Acidité
En solution dans l'eau, l'acide se dissocie partiellement en ion carboxylate, selon l'équation-bilan :
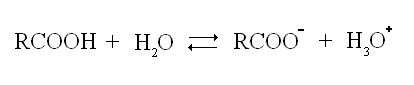
Ce sont des acides faibles dans l'eau (pKA entre 4 et 5).
Comme les alcools, les acides carboxyliques montrent un caractère acide et basique : la déprotonation en ions carboxylates est facile, mais la protonation est plus complexe. Ils possèdent par conséquent un pKA plus faible que celui des alcools. En fait l'acidité des acides carboxyliques s'explique par l'effet inductif dans le groupement carboxyle : la liaison C=O est particulièrement polarisée (électronégativité de l'oxygène supérieure à celle du carbone) ce qui fait que le carbone est électrophile, et il attire par conséquent les électrons de l'autre oxygène. Or cet autre oxygène est lui-même lié à un hydrogène, et cette liaison est aussi polarisée, par conséquent l'électron de l'hydrogène qui s'est rapproché de l'oxygène est attiré à son tour par le carbone électrophile. Cet hydrogène devient par conséquent particulièrement aisément mobile, d'où l'acidité du groupement carboxyle.
La solubilité de l'acide carboxylique croit avec le pH.
Spectroscopie
En infra-rouge (IR), l'acide carboxylique présente 2 bandes de valence :
| Vibration | C=0 | O-H |
|---|---|---|
| Nombre d'onde (cm-1) | 1680-1710 | 2500-3200 |
| Intensité | (forte) | large, moyenne a forte |
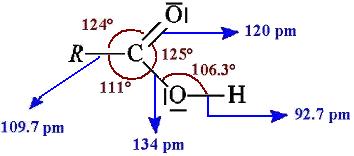
Structure
D'après la théorie VSEPR :
- la géométrie autour de l'atome de carbone (liaisons) est de type trigonale ;
- la géométrie autour de l'atome d'oxygène de la fonction carbonyle (liaison double + doublets libres) est aussi de type trigonale ;
- la géométrie autour de l'atome d'oxygène de la fonction hydroxyle (liaisons + doublets libres) est de type tétraédrique (AX2E2).
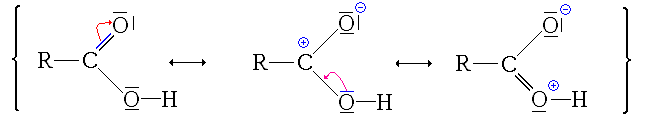
L'acide carboxylique possède plusieurs formes mésomères.
Réactivité
Comme le montre, entre autres, les différentes formules mésomères de l'acide carboxylique :
- Les atomes d'oxygène sont des sites nucléophiles mais aussi des bases de Lewis
- Le carbone central est électrophile
- l'atome d'hydrogène électrophile et acide.
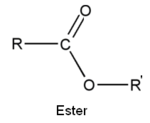
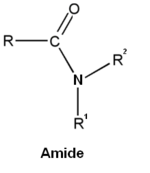
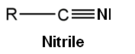
Dérivés
Les acides carboxyliques comptent de nombreux dérivés :
- les esters
- les amides
- les nitriles
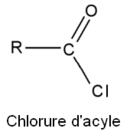
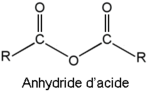
En termes de groupe partant (nucléofuge) l'ordre de facilité est :
Cl- (chlorure d'acyle), RCOO- (anhydride), RO- (ester), -NH2 et -NR1R2 (amides).
Réduction
Oxydation
- dioxyde de carbone (CO2)
Synthèse
Synthèse par oxydation
- des alcools ou des aldéhydes
Les acides carboxyliques peuvent être obtenus par oxydation des aldéhydes, par conséquent en fait d'une double oxydation des alcools primaires.
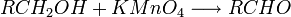
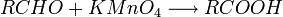
- des alcènes
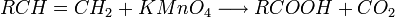
ex : Synthèse de l'Acide acétique par oxydation du propène
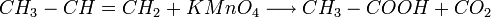
Synthèse à partir d'un dérivé d'acide
Il s'agit simplement des hydrolyses des différents dérivés d'acides
- ester
- hydrolyse en milieu acide : rétrœstérification.
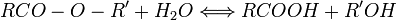
-
- hydrolyse en milieu basique : saponification de l'ester.
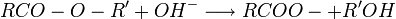 puis
puis 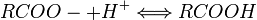
- hydrolyse en milieu basique : saponification de l'ester.
- nitrile
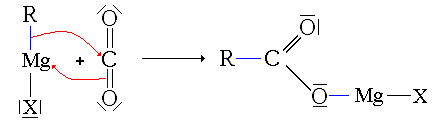
Synthèse par réaction d'un organomagnésien sur le dioxyde de carbone
Réaction
Conditions
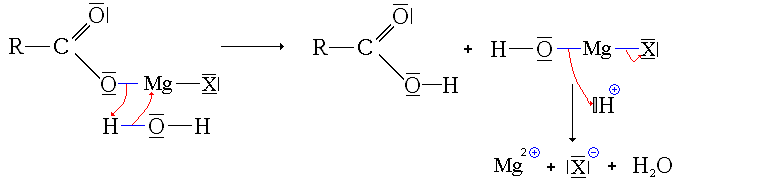
La synthèse a lieu à basse température (-40 °C). Le dioxyde de carbone est alors sous forme solide, dite carboglace. Il est mis en excès. après réaction, on effectue une hydrolyse en milieu acide pour obtenir l'acide carboxylique
Mécanisme
- Première étape : addition de l'organomagnésien sur CO2
- Deuxième étape : hydrolyse en milieu acide
Synthèse malonique
La synthèse malonique est un ensemble de réactions servant à synthétiser de nombreux acides carboxyliques primaires ou secondaires à partir du malonate de diéthyle.
Elle est composée :
- d'une réaction acide-base entre le malonate de diéthyle et de l'éthanoate (de sodium, de potassium, etc. ) ;
- d'une substitution nucléophile, ou on insère le groupe (primaire ou secondaire) voulu pour l'acide carboxylique final :
- d'une double saponification des deux fonctions ester du malonate de diéthyle subsititué, suivie d'une acidification du milieu;
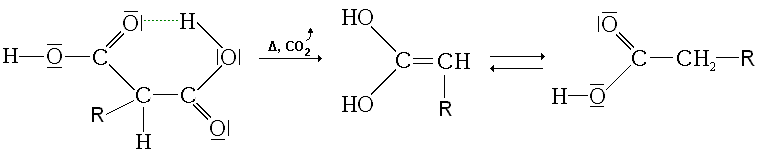
- d'une décarboxylation (dégagement de dioxyde de carbone par chauffage)
- d'un réarrangement du produit final en acide carboxylique par tautomérie.
Cette synthèse est d'autant plus intéressante qu'a priori, elle sert à synthétiser n'importe quel acide carboxylique, puisque, à part un groupe tertiaire, il semble qu'on puisse mettre ce qu'on veut à la place de R.
Notes et références
Liens externes
Recherche sur Amazone (livres) : |
Voir la liste des contributeurs.
La version présentée ici à été extraite depuis cette source le 30/11/2010.
Ce texte est disponible sous les termes de la licence de documentation libre GNU (GFDL).
La liste des définitions proposées en tête de page est une sélection parmi les résultats obtenus à l'aide de la commande "define:" de Google.
Cette page fait partie du projet Wikibis.

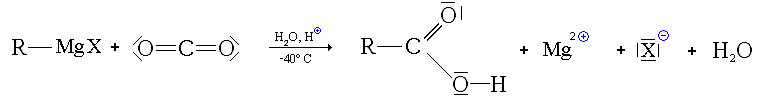
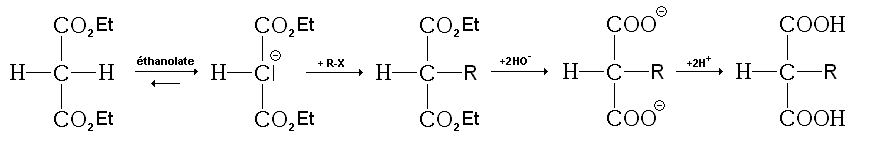

 Accueil
Accueil Recherche
Recherche Début page
Début page Contact
Contact Imprimer
Imprimer Accessibilité
Accessibilité