Azéotrope
Un mélange azéotrope ou azéotropique est un mélange liquide qui bout à température fixe en gardant une composition fixe.
Recherche sur Google Images :

Source image : cocoledico.com Cette image est un résultat de recherche de Google Image. Elle est peut-être réduite par rapport à l'originale et/ou protégée par des droits d'auteur. |
Page(s) en rapport avec ce sujet :
- Présence d'un azéotrope (le définir et montrer que l'ébullition d'un mélange azéotrope est semblable à celle d'un corps pur : liq et vapeur à ... maintien d'une ébullition particulièrement douce (point caractéristique du mélange dans le bouilleur... (source : annecurkpucheu)
- L'azéotrope est , par définition, un point de rencontre entre la courbe de bulle... dans le cas d'un azéotrope positif, le mélange azéotropique bout à une... (source : nte.mines-albi)
- ... Quand l'un des liquides constituant l'azéotrope est de l'eau on parle d'hydrodistillation.... Donc, en chauffant le mélange d'eau et d'alcool à une.... Mis au point par les Arabes au IXème siècle, l'entrainement à la... (source : fr.ekopedia)
Un mélange azéotrope ou azéotropique (a privatif, du grec zêin bouillir et tropos action de tourner) est un mélange liquide qui bout à température fixe en gardant une composition fixe.
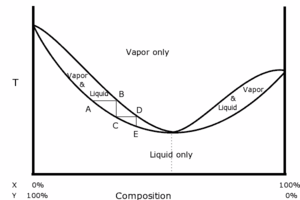
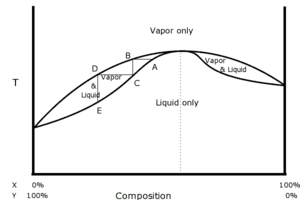
Lorsque on distille un mélange de deux liquides, la température d'ébullition n'est pas forcément comprise entre celles des deux constituants ; elle peut présenter un point d'ébullition supérieur au point d'ébullition des constituants purs (azéotropisme négatif) ou un point d'ébullition inférieur au point d'ébullition des constituants purs (azéotropisme positif). Dans l'un et l'autre des cas, la distillation fractionnée ne permet pas de séparer les deux liquides, mais uniquement l'un d'entre eux et le mélange azéotrope correspondant au point d'ébullition maximal ou minimal.
Par exemple l'alcool à 96 ° (soit 96% d'éthanol et 4% d'eau) est un mélange azéotropique qui bout à 78, 1 °C, température inférieure à celle de l'éthanol pur (Téb : 78, 4 °C). En pratique, une différence de température d'ébullition de 0, 3 °C est complexe à exploiter...
Cependant, on obtient un point azéotrope dans un diagramme binaire, pour des solutions liquides miscibles non parfaites. On parle alors de solutions réelles, où les interactions entre 2 constituants A1 et A2 sont de natures différentes des interactions de type A1↔A1 ou de type A2↔A2. A titre d'exemple, un mélange binaire eau/éthanol.
En chimie organique et en chimie industrielle, on se sert des propriétés azéotropiques de certains solvants avec l'eau pour pouvoir l'extraire du milieu réactionnel (azéotrope toluène/eau, benzène/eau, surtout utilisés pour obtenir de l'éthanol absolu).
On peut citer quelques propriétés du point azéotrope :
- Sa courbe d'analyse thermique est analogue à la courbe d'analyse thermique d'un corps pur.
- La composition de l'azéotrope fluctue avec la pression.
- Le théorème de Gibbs-Konovalov sert à démontrer qu'au point azéotropique, la fraction molaire xL liquide du composé A est égale à la fraction molaire xV vapeur du composé A, c'est-à-dire : xL (A) = xV (A) .
Article connexe
Lien externe
Recherche sur Amazone (livres) : |
Voir la liste des contributeurs.
La version présentée ici à été extraite depuis cette source le 30/11/2010.
Ce texte est disponible sous les termes de la licence de documentation libre GNU (GFDL).
La liste des définitions proposées en tête de page est une sélection parmi les résultats obtenus à l'aide de la commande "define:" de Google.
Cette page fait partie du projet Wikibis.


 Accueil
Accueil Recherche
Recherche Début page
Début page Contact
Contact Imprimer
Imprimer Accessibilité
Accessibilité