Indicateur de pH / Indicateur coloré de pH
Les indicateurs colorés de pH sont des molécules qui ont la capacité de changer de couleur selon l'acidité de leur milieu environnant.
Page(s) en rapport avec ce sujet :
- Le papier pH est un papier absorbant imbibé d'un indicateur coloré universel... Indicateur de pH crésol rouge. Diluer avec de l. eau et/ ou essuyer avec un... (source : dictionnaire.sensagent)
- Note : le terme «indicateur coloré» désignera toujours un «indicateur coloré de pH» dans cet article
Les indicateurs colorés de pH (ou indicateurs acide-base) sont des molécules qui ont la capacité de changer de couleur selon l'acidité (au sens de Brønsted) de leur milieu environnant. La propriété qui lie couleur apparente et pH est nommée halochromisme. Par extension, l'indicateur de pH est un détecteur chimique de l'ion hydronium (ou oxonium) H3O+.
Cette propriété donne aux indicateurs colorés une utilité dans certaines sciences expérimentales telles que la chimie, la biologie ou la médecine. Elle leur confère, d'autre part, un attrait pédagogique qui permet, par exemple, d'introduire au lycée les dosages acide-base sans initiation préalable au suivi pH-métrique ou conductimétrique d'une réaction.
Leurs synthèses conduisant le plus fréquemment à des solides, les indicateurs colorés sont la majorité du temps utilisés en infimes quantités à l'état solvaté (dans l'eau, la soude ou l'éthanol par exemple) dans des solutions aqueuses. Ces quelques gouttes pourront par conséquent colorer particulièrement nettement une solution et la couleur de celle-ci sera sensible aux valeurs que prend son pH. Dans les cas où on ne peut pas mélanger l'indicateur à la solution[1] (cas, par exemple, de l'alimentaire), on peut imbiber un papier spécial de cet indicateur et y déposer une goutte de la solution pour observer le changement de couleur.
Historique
C'est en 1767 qu'a lieu la première utilisation d'un indicateur coloré pour un dosage acide-base. C'est W. Lewis qui proposa d'utiliser un changement de couleur pour caractériser l'équivalence. Jusqu'alors, on utilisait le carbonate de potassium K2CO3 comme base. On observait un dégagement gazeux à l'équivalence.
Le premier indicateur coloré fut par conséquent un extrait de tournesol[4]. Les dosages consistaient alors en l'étude analytique des eaux minérales. Plusieurs autres indicateurs naturels furent rapidement adoptés. On peut citer le chou rouge, l'artichaut, la rose ou encore la betterave. En effet, ces composés présentent tous la propriété de changer de couleur selon le pH. Mais ces composés présentent des défauts importants : leur zone de virage est étendue et peu précise, et elle dépend de la nature même du végétal en question. Un même chou rouge pourra voir ses zones de virage déplacées d'une ou alors deux unités de pH.
Le XIXe siècle voit l'essor énorme de la chimie organique et la mise au point de synthèse de nouvelles substances qui serviront d'indicateurs colorés, comme la phénolphtaléine ou le bleu de bromothymol utilisés par Luck (1877), et la fluorescéine (1876). Ces indicateurs permettent des dosages plus précis.
Aujourd'hui, un très grand nombre d'indicateurs colorés chimiques peuvent être utilisés. Le chou rouge reste utilisé, mais plutôt à titre pédagogique dans les cours de chimie. La teinture de tournesol est de moins en moins utilisée, au profit du bleu de bromothymol surtout.
Quelques indicateurs courants
Voici une liste non exhaustive[5] des principaux indicateurs utilisés en chimie ou en biologie. Les valeurs des transitions et les teintes peuvent fluctuer un peu suivant les conditions d'utilisation (solvants, température, pression, etc. ).
| Indicateur[6] | Couleur[6], [5] (acide) | Transition[6] (approximativement) | Couleur[6], [5] (base) |
|---|---|---|---|
| Bleu de bromothymol, BBT (1re transition) | rose-rouge | ≈0, 0 | jaune |
| Rouge de crésol (acide - 1re transition) | rouge | 0, 0-1, 0 | jaune |
| Méthyl violet | jaune | 0, 0-1, 6 | bleu-violet |
| Vert malachite (acide - 1re transition) | jaune | 0, 2-1, 8 | bleu-vert |
| Bleu de thymol (acide - 1re transition) | rouge | 1, 2-2, 8 | jaune |
| Jaune de méthyle | rouge | 2, 9-4, 0 | jaune |
| Bleu de bromophénol (BBP) | jaune | 3, 0-4, 6 | violet |
| Rouge congo | bleu | 3, 0-5, 2 | rouge |
| Méthyl orange (Hélianthine) | rouge | 3, 1-4, 4 | jaune |
| Méthyl orange en solution dans le xylène cyanole | pourpre | 3, 2-4, 2 | vert |
| Vert de bromocrésol | jaune | 3, 8-5, 4 | bleu |
| Rouge de méthyle | rouge | 4, 2-6, 3 | jaune |
| Papier de tournesol (Azolitmine) | rouge | 4, 5-8, 3 | bleu |
| Pourpre de bromocrésol | jaune | 5, 2-6, 8 | violet |
| Bleu de bromothymol, BBT (2e transition) | jaune | 6, 0-7, 6 | bleu |
| Rouge de phénol (Phénolsulfonephtaléine) | jaune | 6, 6-8, 0 | rouge |
| Rouge neutre | rouge | 6, 8-8, 0 | jaune orangé |
| Rouge de crésol (base - 2e transition) | jaune | 7, 2-8, 8 | rouge |
| Bleu de thymol (base - 2e transition) | jaune | 8, 0-9, 6 | bleu |
| Phénolphtaléine | incolore | 8, 2-10, 0 | rose |
| Thymolphtaléine | incolore | 9, 4-10, 6 | bleu |
| Jaune d'alizarine R | jaune | 10, 1-12, 0 | orange-rouge |
| Alizarine | rouge | 11, 0-12, 4 | violet |
| Carmin d'indigo | bleu | 11, 4-13, 0 | jaune |
| Vert malachite (base - 2e transition) | bleu-vert | 11, 5-13, 2 | incolore |
Indicateurs naturels de pH
Voici une liste non exhaustive d'indicateurs colorés naturels. Contrairement aux indicateurs chimiques purs, les indicateurs naturels contiennent plusieurs composés chimiques qui influent sur la couleur. Les zones de virage changent par conséquent selon la nature du composé utilisé. A titre d'exemple, le jus de chou rouge peut ne pas virer au jaune avant un pH > 14 s'il date de plusieurs jours. De même, la transition du jus de carotte, par exemple, est difficilement observable. L'avantage majeur des indicateurs naturels sur leurs équivalents de synthèse est leur particulièrement faible coût. On les trouve fréquemment directement dans la nature où ils ne coûtent quasiment rien au supermarché, tandis que les indicateurs chimiques dépassent la dizaine d'euros pour quelques grammes de produits purs.
| Indicateur | Couleur (acide) | Transition (approximativement) | Couleur (base) |
|---|---|---|---|
| Chou rouge (acide - 1re transition) | rouge | environ 2, 0-3, 0 | rose |
| Chou rouge (acide - 2e transition) | rose | environ 3, 0-4, 0 | violet |
| Thé | jaune | environ 6, 0-7, 0 | brun |
| Chou rouge (base - 3e transition) | violet | environ 6, 0-7, 0 | bleu |
| Artichaut | incolore | environ 7, 0-8, 0 | jaune |
| Curry | jaune | 7, 4-8, 6 | brun-orangé |
| Curcuma | jaune | 7, 4-8, 6 | brun-orangé |
| Chou rouge (base - 4e transition) | bleu | environ 8, 0-9, 0 | vert |
| Betterave | rouge | environ 11, 0-12, 0 | jaune |
| Chou rouge (base - 5e transition) | vert | environ 12, 0-13, 0 | jaune |
| Thym | jaune | environ 12, 0-13, 0 | brun |
D'autres indicateurs de pH naturels :
- Certains pétales de fleurs (rose, violette ou pensée, pétunia, volubilis, hortensia, lilas, géranium, delphinium, pavot, etc. ) ;
- Quelques fruits ou légumes (rhubarbe, radis, cerise, carotte, fraise, cassis, airelle, généralement la majorité des fruits rouges…) ;
Plusieurs composés chimiques peuvent être à l'origine des propriétés halochromiques de ces indicateurs naturels. En voici quelques-uns :
- Les anthocyanes sont des composés naturels qu'on retrouve chez plusieurs plantes. Ces composés sont rouges dans une solution acide et bleu dans une solution basique. Le chou rouge, qui en contient, fait partie des indicateurs les plus populaires et les plus spectaculaires.
- La curcumine est présente dans le curcuma (et par conséquent dans le curry qui contient du curcuma). Elle est brune en milieu basique et jaune en milieu acide.
- Les caroténoïdes contenus, par exemple, dans les carottes peuvent posséder des propriétés acido-basiques.
Notions associées
Acidité et basicité du milieu
Le pH (potentiel hydrogène) est une grandeur utilisée en sciences expérimentales pour mesurer l'acidité ou la basicité d'une solution. Il est défini par le cologarithme décimal de l'activité des ions H+ dans la solution. Les ions H+ se liant aux molécules d'eau (approximativement 1 pour 1), on mesurera plutôt l'activité des ions hydronium H3O+ (improprement connus comme ions oxonium). Si on estime que les solutions sont assez diluées , l’activité de l’eau sera égale à 1 et celle des ions hydronium sera assimilée la concentration en ces ions, ce qui est généralement le cas pour l'utilisation des indicateurs colorés. On a donc :
![pH = - \log \left( a_{Hˆ+} \right) = - \log \left[ H_3Oˆ+ \right]](illustrations/3046bd80dd1a2c3fe3037ea7efc27cbf.png)
Habituellement, et compte tenu des approximations susmentionnées, on mesurera le pH sur une échelle allant de 1 à 14, quoiqu'il puisse se situer en dehors de cette fourchette. En effet, sachant que le produit ionique de l'eau est toujours vérifié, on a :
pHmin = − log1 = 0 et pHmax = − log10 − 14 = 14
Une solution est dite acide si son pH est inférieur à 7, basique s'il est supérieur à 7 et neutre s'il égal à 7. C'est tout l'intérêt des indicateurs colorés de pouvoir déterminer aisément et rapidement cette acidité.
Zone de virage
Le principe d'un indicateur coloré est d'exister sous deux formes dont l'une prédomine comparé à l'autre selon le pH. On nomme zone de virage la plage de pH dans laquelle aucune des deux formes de l'indicateur n'est majoritaire. Pour les calculs et les expériences, les indicateurs possèdent une zone de virage tabulée, reflétant avec précision le changement de couleur. Si on ne possède pas de données sur la zone de virage mais seulement le pKi, on estime tandis qu'une espèce prédomine sur l'autre quand la concentration de la première est 10 fois supérieure à celle de la seconde[10]. Cela se reflète par une variation d'une unité de pH autour du pKi.
Teinte sensible
La teinte sensible est le nom donné à la couleur que prend la solution dans la zone de virage. Fréquemment, cette couleur correspond au mélange additif des couleurs des formes mises en jeu. Exemple : le bleu de bromothymol (image) a une teinte sensible verte, superposition des couleurs jaune acide et bleue basique. Certains indicateurs peuvent avoir une transition par l'incolore, à cause d'effets électroniques supplémentaires, de présence d'une troisième forme intermédiaire ou encore à cause d'une perte d'énergie de l'indicateur.
Aspects techniques
Nature acido-basique des indicateurs
Un indicateur coloré peut être reconnu comme un couple acide faible/base faible (selon la définition de l'acidité de Brönsted) [11]. On notera InH la forme acide d'un indicateur et In- sa forme basique. L'équilibre acide-base existant entre ces deux formes est donc :
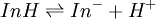 la constante d'acidité associée est
la constante d'acidité associée est ![K_i = \frac{\left[Inˆ- \right]\left[ H_3Oˆ+ \right]} {\left[ InH \right]}](illustrations/40462c536cf6a5aa120eeeed0c0e4cee.png)
où [X] est la concentration de l'espèce X en mol. l-1
On utilise plus fréquemment le pKi qui est égal au cologarithme décimal du Ki : pKi = − logKi Chaque indicateur est caractérisé par le pKi de son couple ou par plusieurs pKi s'il s'agit d'un polyacide.
Les mesures spectrophotométriques permettent de déterminer expérimentalement le pKi d'un indicateur coloré.
D'après la loi de Beer-Lambert, on sait que l'absorbance A (sans unité) d'une solution, mesurée dans un spectrophotomètre ou colorimètre, est proportionnelle à :
- Un cœfficient d'absorption molaire ελ intrinsèque à la substance ainsi qu'à une longueur d'onde λ (en cm-1. l. mol-1) ;
- L'épaisseur l de solution traversée par le rayon de l'appareil (i. e. l'épaisseur de la cuve, en cm) ;
- La concentration c de la surface absorbante (en mol. l-1) :
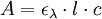
D'autre part, la définition originelle de l'absorbance est :
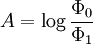
Φ0 et Φ1 sont les flux lumineux indicent et transmis lors du passage dans le spectrophotomètre.
Si le faisceau de l'appareil traverse deux solutions de cœfficient ελ (1) et ελ (2) et de concentrations c1 et c2, on a :
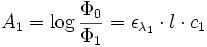 et
et 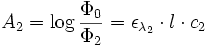
Dans la mesure où l'absorbance est une grandeur additive, on a au final : 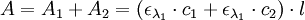
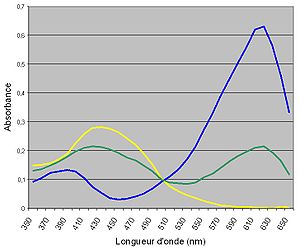
Appliquons par conséquent ce principe aux indicateurs colorés. En exploitant les courbes d'absorbance des différentes formes d'un indicateur coloré, réalisées expérimentalement, on détermine la longueur pour laquelle la différence d'absorbance entre les deux formes de l'indicateur est la plus grande.
Par la suite, on détermine l'absorbance à cette longueur d'onde d'une nouvelle solution, tamponnée à un pH proche de celui attendu pour le pKi. On peut utiliser les relations de Beer-Lambert pour chacune des deux solutions acides et basiques pour déterminer les cœfficients d'absorption et ensuite déterminer par le calcul la concentration de chaque forme de l'indicateur :
![c_{In} = \left[InH\right] + \left[Inˆ-\right]](illustrations/61848be641675da0f8bad6420c737734.png) concentration analytique totale connue de l'indicateur, valable à tout instant
concentration analytique totale connue de l'indicateur, valable à tout instant
![A = \epsilon_{\lambda_{(InH)}}\cdot l \cdot \left[ InH \right]](illustrations/7322c1f11bf4a53a7d01deba1f73dd30.png) absorbance de la solution acide
absorbance de la solution acide
![A = \epsilon_{\lambda_{(Inˆ-)}}\cdot l \cdot \left[ Inˆ- \right]](illustrations/8396107e4816432ab8e41073ae297e3c.png) absorbance de la solution basique
absorbance de la solution basique
L'absorbance de la solution en milieu tamponné, où les deux formes cohabitent, est par conséquent donnée par :
![A = A_{InH} + A_{Inˆ-} = \left(
\epsilon_{\lambda_{(InH)}} \cdot \left[ InH \right] + \epsilon_{\lambda_{(Inˆ-)}} \cdot \left[ Inˆ- \right]
\right) \cdot l
= \left( \epsilon_{\lambda_{(InH)}} \cdot \left[ InH \right] + \epsilon_{\lambda_{(Inˆ-)}} \cdot \left( c - \left[ InH \right] \right)
\right) \cdot l](illustrations/32b86969006da73cd6f7e0d364272af0.png)
[InH] est l'unique inconnue, on en déduit par conséquent aussi [In-]. Reste à déterminer le pKi du couple InH/In- :
![K_i = \frac{ \left[ Inˆ- \right]_{tampon} \left[ H_3Oˆ+ \right]_{tampon}}
{\left[ InH \right]_{tampon}}](illustrations/7e639c9551322ea977ac55c7480fb988.png) et donc
et donc ![pK_i = pH_{tampon} - \log {\frac{ \left[ Inˆ- \right]_{tampon}}
{\left[ InH \right]_{tampon}}}](illustrations/dfe5f9685a10389cfa04cf03a84256d4.png)
Aspects mécanistiques
Une espèce chimique est colorée à partir du moment où elle peut absorber sélectivement des photons à certaines longueurs d'ondes du spectre visible. Elle émet par conséquent de la lumière visible. L'énergie d'absorption du composé est inversement proportionnelle à la longueur d'onde du maximum d'absorption, chaque longueur d'onde d'absorption correspondant à une longueur d'onde d'émission et par conséquent à une couleur. Les molécules colorées sont constituées de l'association de deux types de groupements d'atomes :
Les groupes chromophores
Ils autorisent la molécule de se situer à des énergies d'absorption proches du visible. Il s'agit le plus fréquemment de dispositifs d'électrons conjugués (c'est-à-dire des alternances entre orbitales σ et orbitales π, n ou p). Chaque type de transition électronique (entre orbitales π liantes, n non liantes et π* antiliantes) correspond à des énergies d'absorption différentes[12] (tableau suivant) :
| Groupe chromophore | Transition électronique | Absorption maximale λmax (nm) |
|---|---|---|
| Alcène C=C | π → π* | 180 |
| Carbonyl C=O | π → π* | 180 |
| Benzène C6H5 | n → π* π → π* |
277 200 - 255 |
| Azo N=N | n → π* | 347 |
| Nitroso N=O | n → π* | 665 |
La longueur d'onde du maximum d'absorption augmente quand le nombre d'électrons délocalisés, et par conséquent impliqués dans un dispositif conjugué, augmente lui aussi[14]
Lors d'un virage acide-base, un indicateur coloré change de forme. Sa nouvelle structure possède par conséquent des énergies d'absorption différentes, sa couleur change.
Les groupes auxochromes
Les électrons non partagés de groupes nommés auxochromes tels que –OH, –OCH3, –NH2, –Cl, –N (CH3) 2, peuvent se coupler aux groupements chromophores et ainsi influencer sur la couleur des molécules. C'est par conséquent l'origine des différences entre les couleurs des composés présentant la même structure de base.
Catégories d'indicateurs de pH
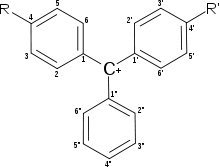
Les indicateurs colorés acide-base classiques peuvent être classés essentiellement selon deux catégories[2], [15] : ceux dérivant du triphénylméthane et ceux dérivant de l'azobenzène. Ces structures permettent la plupart de délocalisations d'électrons π, les groupements venant se greffer sur cette structure pouvant augmenter la conjugaison du dispositif.
Triphénylméthane
Plusieurs groupes fonctionnels différents peuvent se positionner en para sur les deux cycles principaux – ou alors le troisième assez rarement – et ce, du fait de la délocalisation de la charge positive pouvant être portée par le carbone central du triphénylméthane. Il s'agit par conséquent le plus souvent de bases de Lewis possédant un doublet libre d'électrons, c'est-à-dire des composés azotés ou hydrogénés. D'autres groupements peuvent se placer sur les autres positions des deux premiers cycles.
On peut quelquefois observer la présence d'un cycle lactone R-CO-O-R'entre la position 2" et le carbone central. C'est le cas des phtaléines.
Un cycle sulfonate R-SO2-O-R'est quant à lui présent entre les mêmes positions dans les molécules du bleu de bromothymol, de bromophénol, du vert de bromocrésol… Ces composés sont regroupés au sein d'une famille nommée les sulfonephtaléines (ou simplement sulfones, quand on est dans un contexte d'indicateurs de pH).
| Nom \ Position | 2" | 2 | 3 | 4 | 5 | 2' | 3' | 4' | 5' |
|---|---|---|---|---|---|---|---|---|---|
| Bleu de bromothymol | SO3- | Me | Br | OH | MeEt | Me | Br | OH | MeEt |
| Bleu de bromophénol | SO3- | H | Br | OH | Br | H | Br | OH | Br |
| Vert de bromocrésol | SO3- | Me | Br | OH | Br | Me | Br | OH | Br |
| Rouge de crésol | SO3- | H | Me | OH | H | H | Me | OH | H |
| Phénolphtaléine | CO2- | H | H | OH | H | H | H | OH | H |
| Thymolphtaléine | CO2- | Me | H | OH | MeEt | Me | H | OH | MeEt |
| Vert de malachite | H | H | H | NMe2 | H | H | H | NMe2 | H |
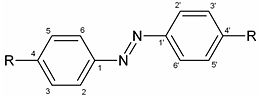
Azobenzène
Nombreuses sont les molécules colorées qui ont pour structure de base celle du 1, 2-diphénylazène, plus connu sous le nom d'azobenzène. Cependant, ces composés sont énormément plus connus comme teintures ou colorants que par leurs propriétés halochromiques. Ces molécules sont dites azoïques. De manière analogue aux dérivés du triphénylméthane, des groupements peuvent se positionner en para essentiellement puis en ortho et méta.
Parmi ces groupements, on peut trouver d'autres cycles, par exemple, pour former des naphtalènes mais également d'autres groupes azoïques. Ces derniers génèrent des molécules qualifiées de diazoïques.
Seuls les indicateurs présents dans le tableau ci-dessous sont réellement utilisés malgré le grand nombre de molécules de ce type.
| Nom \ Position | 2 | 3 | 4 | 5 | 4' |
|---|---|---|---|---|---|
| Hélianthine | H | H | SO3- | H | NMe2 |
| Rouge congo | NH2 | naphtyl | SO3- | sym | |
| Rouge de méthyle | CO2H | H | H | H | NMe2 |
| Jaune de méthyle | H | H | NMe2 | H | H |
| Jaune d'alizarine R | H | CO2H | OH | H | NO2 |
Autres composés halochromiques
Il existe, évidemment, d'autres types d'indicateurs colorés. On peut citer :
- Les anthocyanines : présentes dans la nature, surtout dans le chou rouge, mais également dans certaines fleurs (bleuet, delphinium…) ou dans plusieurs baies (myrtilles).
- Quelques dérivés de l'anthracène, le xanthène, la pyridine ou d'autres composés polycycliques.
- Quelques composés aromatiques nitratés tel que les nitrophénols, nitrobenzènes ou nitrotoluènes.
- D'autres composés atypiques, fréquemment naturels et dérivant quelquefois des anthocyanes.
Mais seuls les dérivés du triphénylméthane et de l'azobenzène sont utilisés en chimie à titre d'indicateur acido-basique.
Applications
Titrages par indicateurs colorés
Les indicateurs changeant de couleur selon le pH, ils servent par conséquent à repérer l'équivalence lors d'un titrage acido-basique. Considérons le titrage d'un acide AH par une base B ou de la base B par l'acide AH. La réaction acido-basique est la suivante :
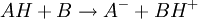
Elle résulte des deux demi-équations des couples AH/A- et BH+/B :
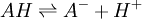 ou
ou 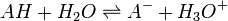 de constante d'équilibre
de constante d'équilibre ![K_{A_{AH/Aˆ-}}=K_{A_1}= \frac{\left[ Aˆ- \right] \left[ H_3Oˆ+ \right]}{\left[AH\right]}](illustrations/6eaab961333273a04f82d01def62bb27.png)
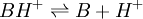 ou
ou 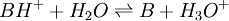 de constante d'équilibre
de constante d'équilibre ![K_{A_{AH/Aˆ-}}=K_{A_1}= \frac{\left[ B \right] \left[ H_3Oˆ+ \right]}{\left[BHˆ+\right]}](illustrations/6e7d70363d305711026e502323dffb4d.png)
Par une étude analytique, on peut déterminer des relations entre le pH à l'équivalence, les concentrations des espèces mises en jeu et le pKA des couples.
| Type de titrage | Exemples de AH |
Exemples de B |
pH à l'équivalence |
|---|---|---|---|
| Acide faible de concentration c par base forte | RCOOH, HXO, NH4+ |
HO-, NH2+ alcoolate… |
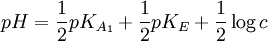 |
| Base faible de concentration c par acide fort | HX, HXO4, HNO3 |
RCOO-, CO32-, NH3… |
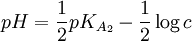 |
| Acide fort par base forte ou base forte par acide fort | HX, HXO4, HNO3 |
HO-, NH2+ alcoolate… |
pH = 7 |
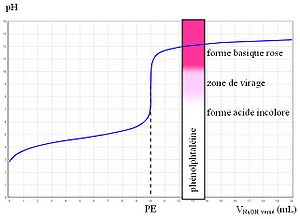
Une fois l'indicateur coloré correct choisi de façon à ce que sa zone de virage contienne le pH du point équivalent (P. E. ) [16], on peut par conséquent réaliser un titrage par indicateur coloré.
- Exemple d'un titrage d'acide faible par de la soude (cas le plus courant)
Le pH du P. E. se situant aux alentours de 9, on utilise quelques gouttes de phénolphtaléine (virage 8, 2-10), ajoutées dans le mélange réactionnel. L'équivalence se repère par conséquent par le changement de couleur. La solution titrée est incolore dans la première partie de la manipulation. On ajoute progressivement de la soude et la solution passe au rose à l'équivalence, c'est-à-dire quand acide et base sont dans les proportions stœchiométriques.
Les indicateurs colorés doivent posséder une absorbance spécifiquement grande, même présent en petite quantité (ce qui est le propre d'un indicateur). Ainsi, on peut les utiliser dans les titrages à une concentration pouvant descendre jusqu'à 10-6 M. On est par conséquent certain, dans ces conditions, de pouvoir apercevoir le virage sans jamais influencer sur le pH de la solution, même si l'indicateur reste un couple acide-base. Quelques gouttes d'un indicateur peuvent finalement colorer des dizaines de mL de solution.
Colorants
Quelques-uns des indicateurs les plus courants sont aussi utilisés comme colorants organiques (textiles surtout). On peut citer le bleu de bromothymol, qui est parfois utilisé comme colorant bleu ou jaune, ou encore le vert de malachite, qui est utilisé comme colorant vert[17].
Chez la majorité des fournisseurs[18] les indicateurs colorés sont d'autre part vendus sous le nom explicite de teinture quand ils sont en solution[19] (photo ci-contre).
Autres utilisations
- Les indicateurs colorés servent en chimie, hormis leur utilisation pour les dosages, pour déterminer rapidement l'acidité ou la basicité d'un milieu. On préférera dans ce cas les utiliser sous la forme d'un papier pH.
- Le rouge de phénol est parfois utilisé par tous pour tester le pH des piscines[20]. Il est fréquemment vendu en petits flacons et est accompagné d'une échelle de teintes (zone de virage du jaune au rouge) servant à déterminer qualitativement le pH de l'eau.
- Quelques indicateurs possèdent aussi des propriétés biologiques, c'est le cas du bleu de bromophénol.
Limites d'utilisations
Les indicateurs colorés doivent être utilisés en particulièrement faibles quantités dans les mesures de pH car ils restent des composés acides ou basiques risquant d'influencer sur le pH de la solution. C'est pour cela qu'ils doivent posséder une grande absorbance. Ils ne peuvent être utilisés dans des solutions conçues pour la consommation, du fait de leur toxicité, et ce, malgré leur faible concentration. De leur côté, les indicateurs naturels possèdent fréquemment des zones de virage particulièrement larges qui empêche toute utilisation pour une mesure de pH précise ou un dosage.
Mélanges d'indicateurs
Indicateur universel
Le terme indicateur universel sert à désigner un mélange d'indicateurs colorés qui a pour vocation de changer de couleur graduellement selon le pH. On peut ainsi obtenir rapidement une idée sur le pH d'une solution, plus exactement qu'un indicateur qui possède une ou alors deux zones de virage.
- Composition[21]
Il existe une composition «classique» de l'indicateur universel. Elle forme la majorité des solutions pour papiers pH variant de 0 à 14. Voici les constituants de ce mélange :
- phénolphtaléine ;
- rouge de méthyle ;
- phenol-4, 4'- (3h-2, 1-benzoxathiol-3-ylidene) bis-2-bromomethyl-6- (1-methylethyl) -S, S-dioxyde ;
- phenol-4, 4'- (3h-2, 1-benzoxathiol-3-ylidene) bis-5-methyl-2- (1-methylethyl) -S, S-dioxyde ;
- solvant : eau/méthanol/propan-1-ol.
- Échelle de teintes
Un indicateur coloré universel possède aussi la particularité de suivre les couleurs du spectre de la lumière blanche quand le pH augmente.
| Couleurs de l'indicateur universel | forme particulièrement acide rouge |
forme acide orange |
forme acide jaune |
forme neutre vert |
forme basique bleu |
forme particulièrement basique violet |
Certains indicateurs se rapprochent des indicateurs universels en possédant deux ou plusieurs zones de virage. C'est le cas, par exemple, d'un indicateur naturel, le chou rouge.
Papier pH
Le papier pH est en fait un papier spécial qui est imbibé d'un indicateur universel[22]. Quand on trempe un morceau de papier pH dans une solution, il prend instantanément la tonalité correspondant au pH du milieu. Les laboratoires de chimie mis à part, on croisera le papier pH dans le cabinet des médecins généralistes qui l'utilisent, par exemple, pour vérifier l'acidité de l'urine.
Il est envisageable d'autre part d'imbiber une bande de papier de n'importe quel indicateur - sans qu'il soit obligatoirement un indicateur universel - puis d'ajouter quelques gouttes de la solution désirée sur cette bande. Cette technique est utilisée pour observer le changement de couleur sans avoir à mélanger l'indicateur au milieu, les indicateurs colorés étant fréquemment toxiques ou nocifs. Le papier tournesol est un exemple de papier n'utilisant pas d'indicateur universel. Il indique l'acidité par une couleur rouge et la basicité par une couleur bleue.
Crayon pH
Le papier pH est utilisé pour donner le pH d'un liquide. Pour déterminer le pH d'un solide, un Crayon pH est parfois utilisé. Ce crayon s'utilise sur le papier, textile, bois, ciment, bitume, batterie, peau, plastique, céramique, métal, ... Il faut passer un coup de crayon sur la surface et attendre quelques secondes. La couleur obtenue indique le pH.
Notes et références
- (pt) Daniela Brotto Lopes Terci, Adriana Vitorino Rossi,, 2001
- Mady Chapon, Véronique Courilleau-Harvelant et Cécille Valette, Chimie des couleurs et des odeurs, Culture et techniques, 1993, pages 157-162.
- Les indicateurs de pH sur le site CultureSciences-Chimie de l'École normale supérieure
- (en) Edmund Bishop, Indicators, Pergamond Press, Oxford, New York, 1972, ISBN 0-08-016617-2
- voir cette liste particulièrement complète pour plus de détails
- (en) David R. Line, Handbook of Chemistry and Physics 84th edition (2003/2004) , CRC Press, 2004
- Sébastien Bruneau (resp. Antoine Delon), Teintes Sensibles : les indicateurs colorés de pH, 2007, voir en ligne.
- Natural pH-Indicators
- (en) Opium Poppy § Flower pH indicator properties, sur le site MaltaWildPlants. com
- Indicateurs acido-basiques et titration par Wyn Locke (trad. C. Jacoboni) sur le site de l'université du Mans
- Jacques Mesplède, Jérôme Randon, 100 manipulations de chimie générale et analytique, Bréal, 2004, p. 46-48, 130-136, ISBN 2-7495-0351-5
- René et Eric Mahé, Didier Devilliers, «Expériences portant sur la notion d'indicateur coloré», dans le Bulletin de l'Union des Physiciens, n°801 de février 1998, pages 299-326
- Sabine Chierici et Olivier Thomas, Fascicules de TP de chimie inorganique de l'UE CHI232 "Chimie expérimentale", UJF, 2006
- Claudine Kahane (resp. ), Fascicule de Cours-TD-TP de l'UE TRA122 "Les couleurs en sciences", TD2, UJF, 2006, pages 27 à 30
- Danielle Cachau-Herreillat, Des expériences de la famille Acide-Base, De Bœck, 2005, pages 71, 112-115, 132-136, 165-167, 326, 339-341
- Bénédicte Nowak-Leclercq, Jean-François Le Maréchal, La chimie expérimentale - chimie générale, Coll. Sciences Sup., Dunod, Paris, 2000, p. 139-148, ISBN 2-10-048461-3
- Sabine Chierici, Fascicules de TP de chimie organique de l'UE CHI232 "Chimie expérimentale", UJF, 2006
- Acros Organics (laboratoires, établissements scolaires), Jeulin (établissements scolaires), Pierron (établissements scolaires, spécifiques) …
- Les indicateurs peuvent aussi être vendus directement en poudre (sels de sodium le plus fréquemment)
- Comment mesurer le pH d'une solution ? sur un site personnel consacré à un TPE
- Bruno Fosset, Christine Lefrou, Arlette Masson, et Christophe Mingotaud, Chimie physique et expérimentale, Ermann, 2000, pages 95-97
- Qu'est-ce que le pH ? sur le site de l'académie de Grenoble
Bibliographie
- (en) Edmund Bishop, Indicators, Pergamond Press, Oxford, New York, 1972, ISBN 0-08-016617-2
- (en) Ferenc Szabadvary, Indicators : A historical perspective, J. Chem. Educ., 1964, 285 p. en ligne
Voir aussi
Liens externes
- Un dossier complet sur les indicateurs colorés, sur le site http ://sbeccompany. fr
- Les indicateurs de pH sur le site CultureSciences-Chimie de l'École normale supérieure
- Indicateurs naturels
- Une page sur les indicateurs colorés
- Expérimenter le jus de chou rouge sur le site http ://www. scienceamusante. net/
- (en) À propos du papier tournesol sur la Wikipédia anglophone
Recherche sur Amazone (livres) : |
Voir la liste des contributeurs.
La version présentée ici à été extraite depuis cette source le 30/11/2010.
Ce texte est disponible sous les termes de la licence de documentation libre GNU (GFDL).
La liste des définitions proposées en tête de page est une sélection parmi les résultats obtenus à l'aide de la commande "define:" de Google.
Cette page fait partie du projet Wikibis.











 Accueil
Accueil Recherche
Recherche Début page
Début page Contact
Contact Imprimer
Imprimer Accessibilité
Accessibilité