Titrage
La titrimétrie ou titrage est une technique de dosage utilisée en chimie analytique pour déterminer la concentration d'une espèce chimique en solution.
Définitions :
- titrer - Donner un titre honorifique à une personne, à une terre; Déterminer le titre d'une solution (source : fr.wiktionary)
- le titrage d'un fil est le rapport entre sa longueur et son poids. (source : ladivine.fortunecity)
La titrimétrie ou titrage est une technique de dosage utilisée en chimie analytique pour déterminer la concentration d'une espèce chimique en solution (ou titre d'une solution).
La méthode de titrage la plus utilisée est la volumétrie ou titrage volumétrique. Elle consiste à utiliser une solution de concentration connue (appelée titrant) pour neutraliser une espèce contenue dans la solution inconnue (appelée analyte ou espèce titrée).
Les titrages volumétriques les plus communs sont les titrages acide-base : L'opérateur fait couler goutte à goutte un acide dans un volume déterminé de base. Ainsi les réactifs réagissent mol à mol. Le titrage base-acide est aussi envisageable.
Le point de neutralisation est connu grâce à un indicateur coloré ajouté dans la solution inconnue (Cet indicateur change de couleur au moment de la neutralisation) ou grâce à une variation du potentiel ou du pH (mesuré au moyen d'une électrode trempant dans la solution inconnue).
Matériel nécessaire
On utilise généralement une burette graduée lorsque le titrage est manuel ou un titrimètre automatique lorsque on souhaite perfectionner la répétabilité et la traçabilité. Le volume de l'échantillon est prélevé au moyen d'une pipette de volume déterminé et est positionné dans un erlenmeyer. La burette contient toujours la solution de réactif titrante dont on connaît la concentration. La burette donne le volume versé de solution titrante et par conséquent nous donnera le point à l'équivalence. La solution à doser sera toujours dans un becher ou autre récipient propre, elle sera en volume précisément connu.
Titrage en solution aqueuse
Pour réaliser un titrage, on réalise une réaction chimique où l'espèce en solution réagit avec une autre substance. L'espèce à doser est nommée réactif titré et la substance ajoutée est nommée réactif titrant
Il est envisageable de réaliser un titrage conductimétrique (pour une réaction acido-basique), un titrage colorimétrique, un titrage pH-métrique, ...
Les titrages pH-métrique
Ce type de titrage est réalisable seulement avec des acides et des bases, faible ou fort, et sous présence d'un PH-mètre ou d'un indicateur de pH colorée.
Titrage d'un acide fort par une base forte
En solution, les acides forts comme l'acide chlorhydrique sont complètement dissociés et donnent des ions 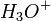 . De même, les bases fortes se dissocient complètement pour libérer des ions
. De même, les bases fortes se dissocient complètement pour libérer des ions 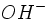 . Les ions
. Les ions 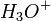 et
et 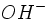 réagissent de la façon suivante :
réagissent de la façon suivante : 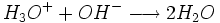 (Voici l'équation générale de neutralisation)
(Voici l'équation générale de neutralisation)
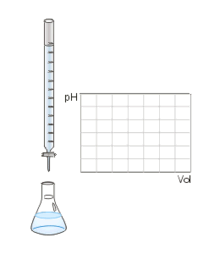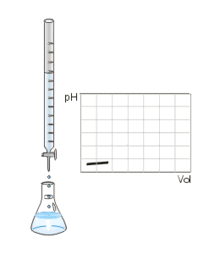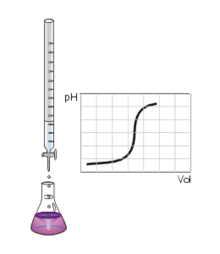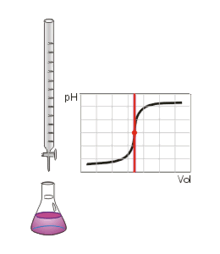
Au volume à l'équivalence l'ensemble des ions H3O + et OH − ont réagi, l'unique réaction qui se produit est celle de l'autoprotolyse de l'eau. Le pH est alors égal à 7. L'équivalence est indiquée soit par un indicateur de pH, soit indirectement par une courbe représentant le pH selon le volume de base versé. Vous devez pour cela relever les valeurs du PH-mètre pour chaque mL de solution versée. Lorsque le pH commence à augmenter de façon significative, versez alors 0, 2 ml de solution entre chaque mesure de pH. Une fois que le pH sera redevenu assez stable reprenez une mesure de pH l'ensemble des ml. En traçant la courbe du pH selon le volume de base versée, on obtient la courbe représentée comme sur le dessin ci-contre. Pour retrouver le volume à l'équivalence, vous devez tracer les tangentes aux deux points d'inflexion (à l'endroit où la courbe change de direction). Les tangentes doivent être parallèles. Tracer une perpendiculaire à ces deux droites, puis grâce à un compas, tracer la médiatrice de la perpendiculaire. La médiatrice doit être parallèle aux tangentes. Le volume à l'équivalence est l'endroit où la médiatrice et la courbe se rencontrent, pour un pH de 7.
Les titrages par indicateurs colorés
Les titrages conductimétriques
Un titrage conductimétrique utilise la capacité des ions à conduire le courant électrique dans un milieu aqueux, on mesure alors la conductance de la solution grâce à une électrode. Comme chaque ion conduit le courant différemment, la conductance fluctue au cours du dosage. Cette notion est directement liée avec la concentration des ions présents. Par exemple : L'ion H3O + conduit mieux le courant que l'ion OH −. Si vous faites réagir les ions H3O +, la conductance de la solution va baisser car ces ions disparaissent (la concentration des ions H3O + diminue). Puis si vous continuez le titrage au-delà du point a l'équivalence, la conductance va monter, car les ions OH − seront de plus en plus nombreux, (la concentration des ions OH − augmente). En relevant les valeurs indiquées par le conductimètre, on peut tracer la droite de la conductance selon le volume versé. Il se dessine alors deux droites adjacentes, en forme de V. Le point adjacent indique le volume à l'équivalence.
Calculs
L'objectif d'un titrage est de trouver la concentration en un élément donné. Il existe pour cela deux moyens envisageables : par le calcul et par un tableau d'avancement. Dans les deux cas il faut connaître l'équation bilan de la réaction.
Méthode mathématique
A l'équivalence, on a
- Donc
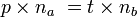
- D'où
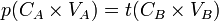
- donc
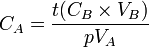
Avec :
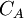 : concentration de la solution connue en mol. L-1
: concentration de la solution connue en mol. L-1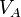 : volume de titrant coulé en litres (L)
: volume de titrant coulé en litres (L) 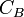 : concentration de la solution inconnue en mol. L-1
: concentration de la solution inconnue en mol. L-1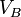 : volume d'échantillon utilisé en litres (L)
: volume d'échantillon utilisé en litres (L) 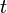 et
et 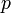 : cœfficents stœchiométriques
: cœfficents stœchiométriques
Cette formule est générale quels que soient les cœfficients (ou nombres) stœchiométriques.
En raisonnant avec les concentrations alors les cœfficients stœchiométriques interviennent.
Tableau d'avancement
Le bilan de la réaction s'écrit comme ceci :
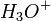 |
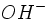 |
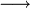 |
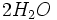 |
|
|---|---|---|---|---|
| Etat initial | 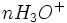 |
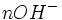 |
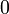 |
|
| Etat intermédiaire | 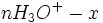 |
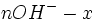 |
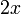 |
|
| Etat Final | 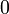 |
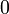 |
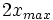 |
Au début du titrage, (lorsque vous n'avez toujours rien versé), vous n'avez que des réactifs et aucun produit de réaction. Au fur et à mesure que votre réaction se déroule, une quantité x de réactif disparaît, tandis qu'en même temps une quantité x de produit apparaît. C'est l'application de la loi de lavoisier. A la fin du titrage, c'est-à-dire lorsque un de vos réactifs a complètement disparu (celui se trouvant dans votre erlen) vous avez atteint l'avancement maximal, votre réaction ne peut pas aller plus loin.
A ce moment-là
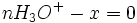
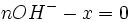
- donc
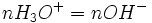
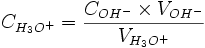
Ce tableau sert à comprendre ce qui ce passe au cours de la réaction et de ne pas vous tromper avec les cœfficients. En effet vous avez juste à les reporter devant le X. Théoriquement lorsque vous avez de l'eau dans votre réaction vous devez écrire "en excès" (vous avez encore plus d'eau qu'il n'en faut pour que la réaction se déroule)
Calcul d'un excès
Au départ la solution titrée est en excès. Après l'équivalence, c'est la solution titrante qui est en excès. Pour une réaction acido-basique, l'acide est limitant au début et pour une oxydo-réduction, c'est l'oxydant qui est limitant avant l'équivalence.
Un excès est une partie des réactifs qui ne réagit pas pendant une réaction chimique et qui se retrouve par conséquent dans les produits de la réaction. On peut doser l'excès de réactif avec une deuxième réaction chimique : c'est un dosage en retour.
Rappels
- Le nombre de mole
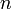 correspond à la quantité de matière d'une espèce chimique.
correspond à la quantité de matière d'une espèce chimique. - La masse molaire
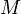 d'un élément est la quantité de matière qu'il faut pour avoir une mole de cet élément. Exemple :
d'un élément est la quantité de matière qu'il faut pour avoir une mole de cet élément. Exemple : 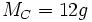 , il faut 12 grammes de carbone pour avoir 1 mole.
, il faut 12 grammes de carbone pour avoir 1 mole. - La masse
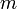 est la quantité de matière pesée.
est la quantité de matière pesée.
- La concentration
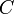 est la quantité de matière contenue dans un litre de solution. Elle est exprimée en mol/L ou en g/L.
est la quantité de matière contenue dans un litre de solution. Elle est exprimée en mol/L ou en g/L.
C = n / V ou C = m / V
Exemple de calcul
On fait réagir du chlorure de sodium NaCl avec du nitrate d'argent AgNO3.
On verse 10 ml de NaCl à 0.2 mol/L dans un becher contenant 20 ml de AgNO3 à 0.2 mol/L.
- M Ag =47 g/mol
- M N = 14 g/mol
- M O = 16 g/mol
Déterminer la masse de l'excès d'AgNO3.
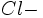 |
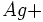 |
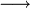 |
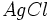 |
|
|---|---|---|---|---|
| Etat initial | 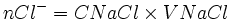 |
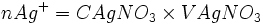 |
0 | |
| Etat intermédiaire | 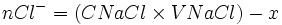 |
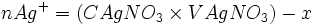 |
 |
|
| Etat final | 0 |  |
xmax |
- nCl − − xmax = 0
- xmax = nCl −
- nAg + − xmax = n'Ag +
- nAg + − nCl − = n'Ag +
Bibliographie
- L. Lopes, «Réactions "totales" en solution aqueuse», dans Bulletin de l'union des physiciens, vol. 99, no 872 (1), Mars 2005, p. 385-396 [ texte intégral ]
Liens externes
- Critère de réaction totale - Application aux dosages
- L. Lopes Titrages acidobasiques de mélanges contenant une espèce forte et une espèce faible : successifs ou simultanés ?
- Titrages pH-métriques - résolution ou simulation avec Excel, en anglais ou portugais
- Graphe de Gran : linéarisation graphique donnant la possibilité de la détermination du point d'équivalence, du pKW (ou pKa) et autres paramètres
Recherche sur Google Images : |
|
"Titrage de la solution diluée" L'image ci-contre est extraite du site intellego.fr Il est possible que cette image soit réduite par rapport à l'originale. Elle est peut-être protégée par des droits d'auteur. Voir l'image en taille réelle (600 × 300 - 17 ko - gif)Refaire la recherche sur Google Images |
Recherche sur Amazone (livres) : |
Voir la liste des contributeurs.
La version présentée ici à été extraite depuis cette source le 30/11/2010.
Ce texte est disponible sous les termes de la licence de documentation libre GNU (GFDL).
La liste des définitions proposées en tête de page est une sélection parmi les résultats obtenus à l'aide de la commande "define:" de Google.
Cette page fait partie du projet Wikibis.


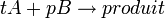
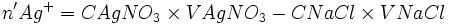
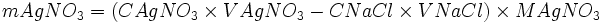

 Accueil
Accueil Recherche
Recherche Début page
Début page Contact
Contact Imprimer
Imprimer Accessibilité
Accessibilité