pH-mètre
Un pH-mètre est un appareil fréquemment électronique donnant la possibilité de la mesure du pH d'une solution aqueuse.
Recherche sur Google Images :

Source image : hellopro.fr Cette image est un résultat de recherche de Google Image. Elle est peut-être réduite par rapport à l'originale et/ou protégée par des droits d'auteur. |
Page(s) en rapport avec ce sujet :
- Propriétés pH - mètre PHT 810 (électrode connectable disponible)... Solution tampon pH4 pour pH - mètre... Solution tampon pH7 pour pH - mètre AT 401... (source : ebro)
Un pH-mètre est un appareil fréquemment électronique donnant la possibilité de la mesure du pH d'une solution aqueuse.
Fonctionnement
Le pH-mètre est le plus souvent constitué d'un boîtier électronique donnant la possibilité de l'affichage de la valeur numérique du pH et d'une sonde de pH constituée d'une électrode de verre donnant la possibilité de la mesure et d'une électrode de référence. Son fonctionnement est basé sur le rapport qui existe entre la concentration en ions H3O + (définition du pH) et la différence de potentiel électrochimique qui s'établit dans le pH-mètre une fois plongé dans la solution étudiée.
Ce dernier est constitué de deux électrodes, l'une standard dont le potentiel est constant et connu (appelée électrode de référence), l'autre à potentiel variable (fonction du pH, nommée électrode de verre). Ces deux électrodes peuvent être combinées ou scindées.
Une fois l'appareil étalonné avec solutions tampon (fréquemment de pH 4, 7 et 10), on peut déterminer la valeur du pH par simple corrélation, la différence de potentiel évoluant par rapport à la valeur du pH selon cette formule :
- ΔE est la différence de potentiel entre les deux électrodes.
- pHa est le pH de la solution à mesurer.
- pHb est le pH de la solution de référence.
- a et b dépendent de l'appareil, ils sont révélés lors de l'étalonnage du pH-mètre.
Étalonnage
On étalonne un pH-mètre avec des solutions tampon. Selon les mesures qu'on va effectuer, on étalonne soit par une solution de pH=7 puis par une solution de pH=4 pour faire des mesures en milieu acide, soit par une solution de pH=7 puis une solution de pH=10 pour des mesures en milieu basique (ces valeurs de pH sont les plus couramment rencontrées chez les solutions tampon) .
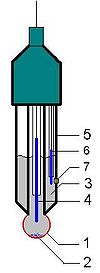
Schéma de la sonde à pH
- Corps de l'électrode de verre
- Cristaux de KCl (visibles occasionnellement quand la solution est sur-saturée)
- Solution saturée en KCl
- Fil conducteur relié à l'électrode de verre
- Verre actif
- Électrode de référence au calomel (autre possibilité : électrode à Ag/AgCl)
Voir aussi
- Arnold Orville Beckman, chimiste, inventeur du pH-mètre.
Recherche sur Amazone (livres) : |
Voir la liste des contributeurs.
La version présentée ici à été extraite depuis cette source le 30/11/2010.
Ce texte est disponible sous les termes de la licence de documentation libre GNU (GFDL).
La liste des définitions proposées en tête de page est une sélection parmi les résultats obtenus à l'aide de la commande "define:" de Google.
Cette page fait partie du projet Wikibis.


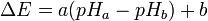

 Accueil
Accueil Recherche
Recherche Début page
Début page Contact
Contact Imprimer
Imprimer Accessibilité
Accessibilité