Méthode de Charpentier - Volhard
La méthode de Charpentier - Volhard sert à doser les ions chlorures par un dosage en retour.
Recherche sur Google Images :

Source image : ecolesurweb.fr Cette image est un résultat de recherche de Google Image. Elle est peut-être réduite par rapport à l'originale et/ou protégée par des droits d'auteur. |
Page(s) en rapport avec ce sujet :
- En milieu basique, on observe la précipitation d'oxyde d'argent Ag2O comme dans la méthode de . Mohr. La méthode de Charpentier - Volhard est inutilisable en ... (source : epl.aurillac.educagri)
- II Méthode de Charpentier - Volhard : A une prise d'essai de la solution d'acide... Préciser le domaine d'utilisation de la méthode de Charpentier Volhard.... (source : chimix)
- ... Salut à tous! J'ai une question à propos de cette méthode pour doser les chlorures : Pourquoi ne peut -on pas doser directement les Cl- par... (source : forums.futura-sciences)
La méthode de Charpentier - Volhard sert à doser les ions chlorures par un dosage en retour.
Principe
tous les dosages s'effectuent en milieu acide nitrique afin d'éviter la formation d'hydroxyde métallique
Première étape : précipitation des chlorures
En présence d'un excès de solution aqueuse de nitrate d'argent (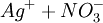 ), il se forme un précipité blanc de chlorure d'argent (AgCl) selon :
), il se forme un précipité blanc de chlorure d'argent (AgCl) selon :
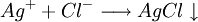
Deuxième étape : dosage de l'excès d'ions argent
L'excès d'ions argent est dosé par une solution titrée de thiocyanate de potassium (K + + SCN −) en formant un précipité de thiocyanate d'argent (AgSCN) de couleur blanche selon :
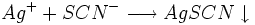
Fin du dosage
La fin du dosage est visualisé par l'utilisation d'un indicateur coloré : l'alun de fer ammoniacal 3. À l'équivalence Ag + / SCN −, la formation du complexe avec l'alun de fer et d'ammonium (NH4Fe (SO4) 2, 12H2O) et le thiocyanate est donnée par l'équation suivante :
![SCNˆ- +Feˆ{3+} \longrightarrow [Fe(SCN)]ˆ{2+}](illustrations/90b6e183b6bf2117255632a3ebb88586.png)
La solution prend alors une couleur rouge-orangée due à la complexation des ions Fe3 + avec les ions SCN − pour donner [Fe (SCN) ]2 +. Cette couleur est visible que quand la concentration du complexe [Fe (SCN) ]2 + = 10 − 5mol. L − 1 (c'est-à-dire quand il n'y a plus d'ions argent à complexer par le thiocyanate)
Protocole
Dosage des chlorures d'un lait
Décantation
Lors du dosage, les constituants des produits peuvent capturer des ions Ag + et ainsi fausser le dosage, par conséquent il faut les éliminer par la décantation.
Dans une fiole jaugée de 200 ml, introduire :
- 20 mL de lait à analyser
- 2 ml d'acétate de zinc, goutte à goutte
- agiter et compléter a 200ml.
- Bien homogénéiser et laisser décanter 10 minutes environ : la décantation doit être nette, sinon recommencer
- filtrer la solution, le filtrat doit être limpide
Dosage du thiocyanate de potassium
Dans un becher :
- Introduire 50 mL d'eau distillée
- 1 mL d'acide nitrique (HNO3\, )
- 2 mL d'alun de fer et d'ammonium
- 5 mL de nitrate d'argent prélevé a la pipette
- Titrer avec la solution de thiocyanate et faire deux essais
Dosage de l'essai
Dans un becher :
- Ajouter 50 ml de filtrat avec une pipette jaugé
- Ajouter 1 ml d'acide nitrique concentré
- Ajouter 2 ml d'alun de fer et d'ammonium
- Ajouter 5 ml de nitrate d'argent a la pipette jaugé et agiter
Titrer l'exces de nitrate d'argent par la solution de thiocyanate de potassium jusqu'à apparition d'une couleur orangé ou complexe chamois (couleur marron clair/orange)
Dosage des chlorures d'un produit a base de viande
Décantation
Dans un erlen :
- Peser une masse de 10 g précisément mesurée
- Ajouter 100 mL d'éthanol a 70°GL (dissolution de la matière grasse) et boucher l'erlen
- Chauffer pendant 15 minutes au bain marie bouillant en remuant de temps à autre
- laisser refroidir a température ambiante
- Ajouter 2 mL de ferrocyanure de potassium
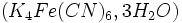
- Agiter
- Ajouter 2 mL d'acétate de zinc
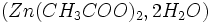
- Agiter
- Laisser reposer 30 minutes a température ambiante
- Transvaser quantitativement dans une fiole de 200ml et ajouter de l'eau distillée jusqu'au trait de jauge
- Bien mélanger et filtrer, reprendre le protocole au point 2.1.2
Calculs
il s'agit d'un dosage en retour : lors de la chute de burette le reste des ions Ag + réagissent avec les ions SCN − versée. une partie des ions Ag + ont précipité avec les ions Cl − avant le début de la chute de burette
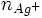 totale
totale 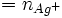 qui a réagi avec les Cl − +
qui a réagi avec les Cl − + 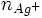 qui a réagit avec les
qui a réagit avec les 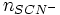
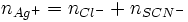
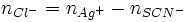
![[Clˆ-] = \frac{ (C_{AgNO_{3}} \times V_{AgNO_{3}}) - (C_{KSCN} \times V_{KSCN}) }{V_{Echantillon}} \times dilutions](illustrations/a184c49853b2e27395469590cdf69f53.png)
![m_{NaCl} = [Clˆ-]\times V_{Echantillon} \times M_{NaCl} \,](illustrations/703bc96e72638296afd1a4edb76e0725.png)
Intérêts du dosage
Dans le lait
La concentration des chlorures du lait est le plus souvent de l'ordre de 1, 6 à 1, 8 g·l-1. Si le taux est plus faible, cela indique une dilution du lait.
Dans des produits à base de viande
Un trop fort taux de chlorures dans les produits carnés indique une fraude probable. Le sel augmente le pouvoir de rétention en eau des protéines et par conséquent un gain de poids dû à l'eau. La concentration en sel dans une préparation à base de viande est généralement de l'ordre de 4%.
Recherche sur Amazone (livres) : |
Voir la liste des contributeurs.
La version présentée ici à été extraite depuis cette source le 30/11/2010.
Ce texte est disponible sous les termes de la licence de documentation libre GNU (GFDL).
La liste des définitions proposées en tête de page est une sélection parmi les résultats obtenus à l'aide de la commande "define:" de Google.
Cette page fait partie du projet Wikibis.


 Accueil
Accueil Recherche
Recherche Début page
Début page Contact
Contact Imprimer
Imprimer Accessibilité
Accessibilité