Ozonolyse
Une ozonolyse est la réaction d'un alcène avec une molécule d'ozone.

Catégories :
Réaction d'oxydo-réduction organique - Test chimique - Chimie analytique - Cycloaddition
Recherche sur Google Images :
Source image : chemwiki.ucdavis.edu Cette image est un résultat de recherche de Google Image. Elle est peut-être réduite par rapport à l'originale et/ou protégée par des droits d'auteur. |
Page(s) en rapport avec ce sujet :
- Ozonolyse est le fendage de l'alcène ou alcyne avec l'ozone à la forme composés... Les résultats de la réaction dépendent du type du lien de multiple étant oxydé et ... importante pour déterminer la structure des molécules organiques.... (source : worldlingo)
- Montrez que les produits de réaction peuvent fluctuer selon les conditions... Qui plus est , la molécule d'ozone possède à la fois un caractère nucléophile et un... Donc, la fin de l'ozonolyse est notée lorsque la coloration de la solution... (source : er.uqam)
- ... L'ozone donne des réactions intéressantes avec les composés éthyléniques.... L'ozonolyse est aussi utilisée pour préparer des composés... (source : faidherbe)
Une ozonolyse est la réaction d'un alcène avec une molécule d'ozone.
Historique
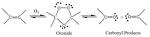
La réaction d'ozonolyse a été découverte par Harries en 1903. Elle a été beaucoup utilisée pour localiser la position des doubles liaisons des composés éthyléniques dans les molécules organiques. Désormais des techniques spectroscopiques permettent des analyses plus poussées avec des quantités de produit plus faibles, et sans dégradation. Cette réaction sert en synthèse organique, pour transformer des alcènes en cétone/aldéhyde/acide carboxylique.
Mécanisme
Cette molécule d'ozone s'attache sur les carbones impliqués dans une double liaison carbone-carbone pour donner un molozonide, ou ozonide primaire.
Ce molozonide, particulièrement instable, se scinde en deux molécules qui réagissent l'une sur l'autre pour donner un ozonide secondaire.
L'ozonide, explosif, est généralement traité aux environs de -80 °C (193 K), et se sépare en deux cétones ou aldéhydes, en fonctions des substituants initiaux de l'oléfine, ainsi qu'un atome d'oxygène (qui pourra réagir avec les autres produits de réaction s'il n'est pas capté, par du diméthylsulfure, par exemple, qui sera oxydé en diméthylsulfoxyde (DMSO) ).
Les réactions sont celles de réduction avec des catalyseurs de type hydrogène H2 ou platine Pt (métal), ou d'oxydation avec du peroxyde d'hydrogène/eau oxygénée H2O2.
Précaution
L'ozone est un composé assez dangereux. D'une part il est toxique, et d'autre part explosif. Il faut par conséquent veiller à l'utilisation d'une sorbonne bien ventilée, et capter les effluents à la source pour destruction. D'autre part, concernant le caractère explosif, il ne faut pas avoir de haute concentration en ozone, et par conséquent éviter de trop refroidir le milieu réactionnel, ce qui a pour effet d'augmenter la solubilité de l'ozone dans le solvant (voire de liquifier l'ozone, explosion assurée).
Recherche sur Amazone (livres) : |
Voir la liste des contributeurs.
La version présentée ici à été extraite depuis cette source le 30/11/2010.
Ce texte est disponible sous les termes de la licence de documentation libre GNU (GFDL).
La liste des définitions proposées en tête de page est une sélection parmi les résultats obtenus à l'aide de la commande "define:" de Google.
Cette page fait partie du projet Wikibis.

 Accueil
Accueil Recherche
Recherche Début page
Début page Contact
Contact Imprimer
Imprimer Accessibilité
Accessibilité