Concentration molaire
La concentration molaire, ou molarité, est la quantité de matière de soluté par unité de volume de solution. Son symbole est C ; cependant, la majorité du temps, lorsque on parle successivement de la concentration de plusieurs espèces chimiques différentes,...
Recherche sur Google Images :

Source image : web-sciences.com Cette image est un résultat de recherche de Google Image. Elle est peut-être réduite par rapport à l'originale et/ou protégée par des droits d'auteur. |
Page(s) en rapport avec ce sujet :
- ... La concentration molaire C d'une espèce chimique dissoute dans une solution est la quantité de matière de soluté dissout dans un litre de ... (source : fr.wikiversity)
- Concentration molaire, dissolution, préparation de solutions, cours, seconde.... Calculer la concentration molaire en glucose de la solution préparée.... (source : guy.chaumeton.pagesperso-orange)
La concentration molaire, ou molarité, est la quantité de matière de soluté par unité de volume de solution. Son symbole est C ; cependant, la majorité du temps, lorsque on parle successivement de la concentration de plusieurs espèces chimiques différentes, on utilise plutôt la notation [symbole de l'espèce] (ex : [Cu2+] : concentration en ion cuivre II). Son unité usuelle est la mole par litre (mol·L-1) et ses sous-multiples.
La concentration est une grandeur intensive comme la température ou la pression, c'est-à-dire qui ne dépend pas de la quantité de matière. Elle ne peut être définie que si le milieu est homogène ; sa valeur étant semblable en chaque lieu de la solution.
|
|
|
Une solution est dite de 1 molaire si sa concentration molaire est de 1 mol·L-1. C'est la principale unité de concentration utilisée en chimie des solutions.
Il est envisageable de calculer la concentration molaire constituée par l'ajout de solvant lors d'une dilution, grâce à la formule :
encore noté :
En effet, la quantité de matière ne change pas lors d'une dilution :
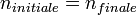
Et comme 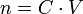
Alors : 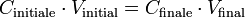
Soit F le cœfficient de dilution, on obtient : 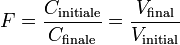
Voir aussi
Recherche sur Amazone (livres) : |
Voir la liste des contributeurs.
La version présentée ici à été extraite depuis cette source le 30/11/2010.
Ce texte est disponible sous les termes de la licence de documentation libre GNU (GFDL).
La liste des définitions proposées en tête de page est une sélection parmi les résultats obtenus à l'aide de la commande "define:" de Google.
Cette page fait partie du projet Wikibis.

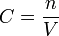
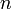 est la quantité de matière de soluté (exprimée en moles d'unité mol)
est la quantité de matière de soluté (exprimée en moles d'unité mol) 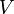 le volume de la solution (exprimé en litre)
le volume de la solution (exprimé en litre) 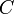 la concentration molaire exprimée en mol·L-1 (mole par litre)
la concentration molaire exprimée en mol·L-1 (mole par litre) 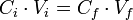

 Accueil
Accueil Recherche
Recherche Début page
Début page Contact
Contact Imprimer
Imprimer Accessibilité
Accessibilité