Solution tampon
En chimie, une solution tampon est une solution qui maintient approximativement le même pH malgré l'addition de petites quantités d'un acide ou d'une base, ou malgré une dilution.
Recherche sur Google Images :
Source image : tradevv.com Cette image est un résultat de recherche de Google Image. Elle est peut-être réduite par rapport à l'originale et/ou protégée par des droits d'auteur. |
Page(s) en rapport avec ce sujet :
- une solution tampon est une solution qui résiste à la variation du pH lors de l'addition d'un acide fort ou d'une base forte... (source : al)
- (tampon à la dilution). Ainsi, les solutions d'acide fort ou de base forte ne forment pas de bonnes solutions tampons car si ce sont des tampons... (source : subaru2.univ-lemans)
- une solution tampon est une solution dont le pH ne fluctue pas ou peu lors d'un ajout d'un acide ou d'une base, ou lors d'une dilution. - un pseudo tampon est ... (source : educnet.education)
En chimie, une solution tampon est une solution qui maintient approximativement le même pH malgré l'addition de petites quantités d'un acide ou d'une base, ou malgré une dilution. Si l'un de ces trois critères n'est pas vérifié alors la solution est une solution pseudo-tampon.
Une solution tampon est composée :
- soit d'un acide faible HA et de son anion A– [1]
Il s'agit par exemple du couple CH3COOH/CH3COO–, ou encore du couple NH4+/NH3.
- soit d'une base faible BOH et de son cation B+ [2]
On trouve dans le sang humain une solution tampon physiologique constituée par le couple H2CO3/HCO3- qui maintient le pH sanguin entre 7, 35 et 7, 45.
On évalue la capacité d'une solution tampon à lutter contre les changements de pH par le pouvoir tampon (noté PT ou encore τ).
Le pouvoir tampon maximal d'une solution est obtenu pour un mélange équimolaire entre (par exemple) l'acide faible HA et son anion correspondant A–. Dans ce cas le pH est égal à la valeur du pKa du couple en solution.
En effet, selon la relation de Henderson-Hasselbalch : ![pH = pK_a + log(\frac{[Aˆ-]}{[AH]})](illustrations/a8d3f1c59f371b42194f59dff0cd84d3.png) avec [A -] la concentration de la base conjuguée et [AH] la concentration de l'acide.
avec [A -] la concentration de la base conjuguée et [AH] la concentration de l'acide.
Or dans le cadre des solutions tampon, on a [AH] = [A-]
On a donc : pH = pKa + log (1) = pKa
D'où pH = pKaLe pouvoir tampon maximal est d'autant plus important que la solution tampon est concentrée : PTmax = 1.15C (avec C la concentration de l'acide faible et de son anion correspondant) .
Il existe aussi des tampons redox qui vont fixer approximativement le potentiel des solutions et des tampons ioniques qui vont fixer approximativement la force ionique des solutions.
Le pH d'une solution tampon
Le pH est maintenu constant grâce à l'absorption ou à la libération d'un ion H+ par les espèces en présence dans la solution.
Par exemple l'acide acétique (qui est un des constituants du vinaigre) donne :
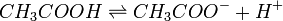
Cette réaction est réversible et en équilibre. Quand un composé de ce type est présent dans une solution, les deux espèces moléculaires CH3COOH et CH3COO- sont par conséquent présentes. Ainsi, si vous ajoutez par exemple un acide à cette solution, une partie de ceux-ci vont être consommés dans la réaction suivante :
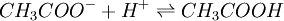
La proportion de molécules CH3COO- et CH3COOH va par conséquent être modifiée, mais le pH quant à lui fluctuera nettement moins que si ces molécules n'étaient pas présentes dans l'eau.
C'est ce qu'on nomme "l'effet tampon".
Aspects mathématiques
- L'évolution du pH
On prendra tout d'abord la définition du pH tel que donnée dans la relation de Henderson-Hasselbalch.
On considère par conséquent que : ![pH = pK_a + log(\frac{[Aˆ-]}{[AH]})](illustrations/a8d3f1c59f371b42194f59dff0cd84d3.png)
avec [A-] la concentration de la base conjuguée et [AH] la concentration de l'acide.
Après la réaction chimique, il y aura par conséquent x produit et 1-x réactif. C'est à dire en faisant réagir l'acide A avec une base je vais entrainer la formation de x base du couple acido-basique correspondant. Il me restera que 1-x acide A.
Notre équation devient pH = pKa + log (x / (1 − x) ) .
Il faut étudier les variations de la fonctions ph selon x c'est-à-dire de l'espèce chimique réactive apportée (cela peut être de la soude ou tout autre base forte).
Il faut par conséquent dériver cette première expression et on trouve que ph'= 1 / ln (10) * 1 / (x (1 − x) ) . Le maximum de cette fonction dérivée nous donnera la quantité x où pH = pKa, caractéristique des solutions tampons. Pour par conséquent trouver quel est le "x" maximum de la fonction pH'il nous faut la dériver une nouvelle fois. Cela donne pH"= (1/ln (10) ) * (2x-1) / (x² (1-x²) ).
Résolvons pH" = 0; cela donne x = 0.5. Il faut par conséquent apporter une demi fois de moins de base que d'acide pour réaliser une solution tampon.
- Le pouvoir tampon PT (ou τ)
Le pouvoir tampon (PT) est la fonction qui montre la capacité de résistance de la solution tampon à des éléments perturbateurs.
On définit ce pouvoir tampon comme étant la fonction PT = dY / dpH.
L'objectif du jeu est de la rendre maximale, tel qu'on apporte le maximum d'élément perturbateur "y" à la solution pour une variation minime du pH.
Nous sommes dans le cas où le dispositif est constitué. On a par conséquent A=AH. On désignera cette quantité sous la variable C.
On reprend par conséquent la relation d'origine, pH = pKa + log (A--y) / (AH+y).
En dérivant cette expression on obtient ph'=1/ln (10) * (2C) / (C²-y²). On a posé que le pouvoir tampon est l'inverse de la dérivée effectuée auparavant.
On obtient PT = ln (10) * (C²-Y²) / (2C).
Pour trouver le maximum de Pouvoir Tampon il faut dériver la fonction PT et résoudre PT'= 0. On peut observer que le pouvoir tampon est maximal lorsque on ajoute aucune entité perturbatrice par conséquent pour y = 0. Ainsi obtient t-on PTmax = (ln (10) / 2) * c.
Liens externes
- Calcul rigoureux du pH et le pouvoir tampon des solutions aqueuses avec Excel (en anglais ou portugais)
Voir aussi
Notes et références
- On évite le terme de base forte conjuguée car on prend en compte la théorie acido-basique d'Arrhenius et non de Brønsted.
- Cf note précédente.
Recherche sur Amazone (livres) : |
Voir la liste des contributeurs.
La version présentée ici à été extraite depuis cette source le 30/11/2010.
Ce texte est disponible sous les termes de la licence de documentation libre GNU (GFDL).
La liste des définitions proposées en tête de page est une sélection parmi les résultats obtenus à l'aide de la commande "define:" de Google.
Cette page fait partie du projet Wikibis.


 Accueil
Accueil Recherche
Recherche Début page
Début page Contact
Contact Imprimer
Imprimer Accessibilité
Accessibilité