Loi de dilution d'Ostwald
La loi de dilution d'Ostwald, du nom de Wilhelm Ostwald, est une loi concernant les réactions acido-basiques sur l'eau, qui dit que la dilution augmente la dissociation de l'acide.
Recherche sur Google Images :

Source image : homeopathiestress.e-monsite.com Cette image est un résultat de recherche de Google Image. Elle est peut-être réduite par rapport à l'originale et/ou protégée par des droits d'auteur. |
Page(s) en rapport avec ce sujet :
- Il existe en effet une loi de dilution nommée loi d'Ostwald qui décrit que dans une solution particulièrement diluée la dissociation est toujours totale ; autrement dit... (source : homeopathiestress.e-monsite)
- IV] Application de la loi d'action de masse aux différentes solutions ioniques. 1) Loi de dilution d'Ostwald. Considérons l'équilibre chimique suivant : AB... (source : intellego)
- Si la loi de dilution d'Ostwald est vérifiée, l'électrolyte faible tend à se dissocier totalement à dilution illimitée, par conséquent à se comporter comme un... (source : educnet.education)
La loi de dilution d'Ostwald, du nom de Wilhelm Ostwald, est une loi concernant les réactions acido-basiques sur l'eau, qui dit que la dilution augmente la dissociation de l'acide (respectivement la protonation de la base) .
Cas d'un acide faible
Un acide faible, noté AH, réagit avec l'eau de la manière suivante :
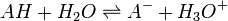 .
. On pose [AH]0 = c, et [H3O + ] = [A − ] = x avec 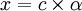 où α est le cœfficient de dissociation.
où α est le cœfficient de dissociation.
On a alors la constante d'acidité Ka :
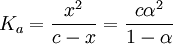
α tend vers 1 si et uniquement si 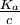 augmente, or Ka est une constante. Par conséquent la dissociation de l'acide augmente si c diminue, par conséquent avec la dilution.
augmente, or Ka est une constante. Par conséquent la dissociation de l'acide augmente si c diminue, par conséquent avec la dilution.
À c fixée, la dissociation augmente avec la constante Ka, or pKa = − logKa par conséquent plus l'acide est fort, plus il est dissocié dans l'eau.
Cas d'une base faible
Une base faible, notée B −, réagit avec l'eau de la manière suivante :
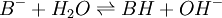 .
. On pose [B − ]0 = c, et [OH − ] = [BH] = x avec 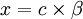 , où β est le cœfficient de protonation.
, où β est le cœfficient de protonation.
Comme avant, on obtient : 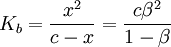 .
.
De même, β tend vers 1 si et uniquement si 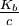 augmente, or Kb est une constante, par conséquent la base est d'autant plus protonée qu'elle est diluée.
augmente, or Kb est une constante, par conséquent la base est d'autant plus protonée qu'elle est diluée.
Recherche sur Amazone (livres) : |
Voir la liste des contributeurs.
La version présentée ici à été extraite depuis cette source le 30/11/2010.
Ce texte est disponible sous les termes de la licence de documentation libre GNU (GFDL).
La liste des définitions proposées en tête de page est une sélection parmi les résultats obtenus à l'aide de la commande "define:" de Google.
Cette page fait partie du projet Wikibis.


 Accueil
Accueil Recherche
Recherche Début page
Début page Contact
Contact Imprimer
Imprimer Accessibilité
Accessibilité