Hydroxyde de sodium
L'hydroxyde de sodium est un solide ionique de formule statistique NaOH. La solution issue de la dissolution de ce cristal est nommée soude, ou alors soude caustique.

Catégories :
Produit chimique corrosif - Test chimique - Chimie analytique - Hydroxyde - Composé du sodium - Produit chimique domestique - Agent conservateur - Régulateur alimentaire de pH
Recherche sur Google Images :

Source image : french.alibaba.com Cette image est un résultat de recherche de Google Image. Elle est peut-être réduite par rapport à l'originale et/ou protégée par des droits d'auteur. |
Page(s) en rapport avec ce sujet :
- L'hydroxyde de sodium est une base forte dont les solutions aqueuses, en particulier alcalines, .... de soude renfermant plus de 20 % d'hydroxyde de ... (source : paincroquant)
- Soude, Soude caustique, Hydrate de sodium, Caustique.... L'hydroxyde de sodium est une substance inorganique ne se bioaccumulant pas le long... (source : cedre)
- Commentaire, L'hydroxyde de sodium est une base forte qui permet de ajuster le ... Le savon s'obtient par action de la soude caustique (sodium hydroxide) sur ... (source : leflacon.free)
| Hydroxyde de sodium | |||||
|---|---|---|---|---|---|
 |
|||||
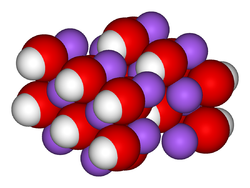
| Structure spatiale du réseau cristallin de l'hydroxyde de sodium. | |||||
| Général | |||||
| Nom IUPAC | Hydroxyde de sodium | ||||
| No CAS | (anhydre) (·H2O) |
||||
| No EINECS | (anhydre) (·H2O) |
||||
| PubChem | |||||
| No E | E524 | ||||
| SMILES |
|
||||
| InChI |
|
||||
| Apparence | solide de formes variables, blanc, deliquescent, inodore. [1] | ||||
| Propriétés chimiques | |||||
| Formule brute | NaOH | ||||
| Masse molaire[2] | 39, 9971 ± 0, 0004 g·mol-1 H 2, 52 %, Na 57, 48 %, O 40 %, |
||||
| pKa | Base forte | ||||
| Propriétés physiques | |||||
| T° fusion | 318 °C[1] | ||||
| T° ébullition | 1 390 °C[1] | ||||
| Solubilité | dans l'eau à 20 °C : 1 090 g·l-1[1] | ||||
| Masse volumique | 2, 1 g·cm-3[1] | ||||
| Pression de vapeur saturante | 0, 13 kPa à 739 °C 2, 67 kPa à 953 °C 13, 3 kPa à 1 111 °C 53, 3 kPa à 1 286 °C |
||||
| Thermochimie | |||||
| ΔvapH° | 175 kJ·mol-1 (1 atm, 1 388 °C) [3] | ||||
| Précautions | |||||
|
|
|||||
|
|||||
|
|
|||||
| Phrases R : 35, | |||||
| Phrases S : 1/2, 26, 37/39, 45, | |||||
|
|
|||||
|
|||||
|
|
|||||
|
|
|||||
 |
|||||
|
|
|||||
 Danger |
|||||
| Peau | Irritant | ||||
| Yeux | Irritant | ||||
| Composés apparentés | |||||
| Cations apparentés | Hydroxyde de potassium | ||||
|
|
|||||
L'hydroxyde de sodium est un solide ionique de formule statistique NaOH. La solution issue de la dissolution de ce cristal est nommée soude, ou alors soude caustique. La solution aqueuse d'hydroxyde de sodium peut être vendue sous le nom de «lessive de soude». Ce produit est assez courant dans le commerce, présenté comme déboucheur de canalisations.
«Soude caustique» ne veut pas dire concentrée : c'est pour préciser clairement que ce n'est pas du carbonate de soude (Na2CO3), jadis nommé soude aussi.
L'hydroxyde de sodium se présente le plus souvent sous la forme de pastilles ou de billes blanches, corrosives et hygroscopiques.
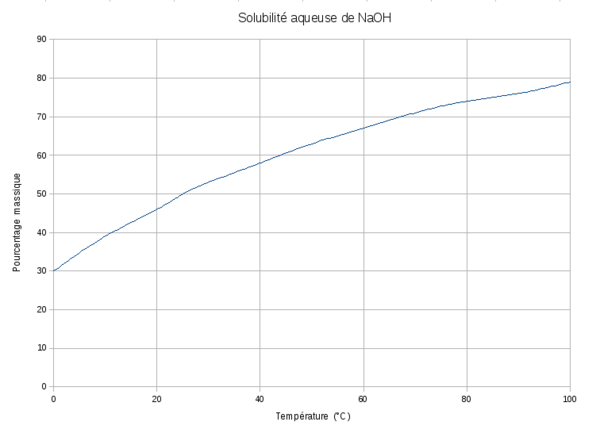
L'hydroxyde de sodium est particulièrement soluble dans l'eau et soluble dans l'éthanol[7]. Sa Dose journalière acceptable est non spécifiée depuis 1965[7].
La soude est une solution chimique transparente et corrosive.
L'ion hydroxyde est une base forte.
Techniques de fabrication
Historique
Dans l'Antiquité, on utilisait la soude végétale. La soude, mot qui désignait alors le carbonate de sodium, provenait des cendres obtenues par la combustion de plantes halophytes comme la salicorne ou les Soudes. La soude caustique est ensuite obtenue par caustification (voir ci-dessous). En 1791, le chimiste Nicolas Leblanc invente un procédé permettant d'obtenir du carbonate de sodium à partir d'eau de mer, procédé qui sera supplanté par le procédé Solvay en 1861 (de Ernest Solvay). Ces procédés permettent de diminuer les coûts de revient de la soude. À la fin du XIXe siècle l'avènement de l'électricité permet la production directe de soude par électrolyse d'une solution de chlorure de sodium. Actuellement 99 % de la soude produite est d'origine électrochimique.
Électrolyse de saumure (eau saturée en sel)
La soude est obtenue par électrolyse du chlorure de sodium NaCl.
La soude s'obtient pour l'instant surtout par une électrolyse à mercure (anode : titane ; cathode : mercure). Cette opération produit en même temps du chlore, de la soude et de l'hydrogène. Mais le mercure est un métal lourd nocif par bioaccumulation ainsi qu'à particulièrement faible dose, plus toujours quand il est transformé en mono- ou di-méthylmercure par les bactéries. Il est volatile et non dégradable, et passe aisément la barrière des poumons, ce qui en fait un des polluants majeurs de l'Environnement, en augmentation dans l'ensemble des mers. C'est pourquoi ce procédé disparaitra d'ici 2020 et est en cours de remplacement par des électrolyses à membranes[réf. nécessaire].
Il existe un autre procédé : électrolyse à diaphragme, qui comportait de l'amiante, substituée en France par un matériau composite depuis la fin des années 1990.
À partir de carbonate de sodium
Cette technique était celle utilisée jadis. Elle est toujours utilisée en Amérique du Nord où se trouvent des gisements naturels de carbonate de sodium. C'est un ajout de chaux (matière) au carbonate de sodium. On parle de caustification ou de caustication. La réaction s'écrit :
Na2CO3 + Ca (OH) 2 → CaCO3 + 2NaOH
Fabrication de la chaux :
Par calcination du calcaire (CaCO3) aux à peu près de 900 °C on obtient de la chaux vive (oxyde de calcium : CaO) et un fort dégagement de dioxyde de carbone (CO2) :
La réaction s'accompagne d'une perte de masse d'environ 45 %, correspondant à la perte en dioxyde de carbone selon la formulation chimique suivante :
CaCO3 → CaO + CO2
La transformation de chaux vive en chaux éteinte, s'effectue par ajout d'eau (H2O). Cette opération d'extinction produit l'hydroxyde de calcium Ca (OH) 2 avec un fort dégagement de chaleur :
Utilisations
- L'hydroxyde de sodium est utilisé en grande quantité par plusieurs industries, essentiellement comme base surtout pour la fabrication des pâtes et papiers, de produits chimiques et plastiques, du savon et de produits détergents généralement, de certains textiles artificiels, de l'aluminium (traitement de la bauxite). La soude permet de réguler le pH et régénérer les résines échangeuses d'ions des stations de traitement des eaux.
- En agro-alimentaire elle permet de nettoyer les installations (circuits, bouteilles), modifier l'amidon, épluchage chimique, etc. C'est aussi un additif alimentaire (E524[8]), il sert comme régulateur de l'acidité[9] et il est utilisé dans une large gamme de produits[10].
- Les déboucheurs chimiques sont fréquemment à base d'hydroxyde de sodium.
- La production mondiale de 1998 était d'environ 45 millions de tonnes. L'hydroxyde de sodium est la base la plus couramment utilisée en laboratoire.
- La soude est parfois utilisée pour stocker de l'énergie solaire sous forme chimique. En effet, la réaction entre la soude et l'eau est fortement exothermique. Une fois la soude diluée, il suffit d'utiliser directement l'énergie solaire pour faire s'évaporer l'eau et revenir à l'état d'origine.
- La soude est aussi utilisée comme un réactif pour des tests de chimie. En effet, en présence de certains cations métalliques, la soude forme un précipité d'une certaine couleur.
| cation métallique | couleur du précipité |
| Cu2+ | bleu |
| Fe2+ | vert |
| Fe3+ | rouille |
| Zn2+ | blanc |
| Al3+ | blanc |
| Ag+ | blanc |
- La soude est utilisée dans certains produits défrisants pour cheveux, mais a tendance à être abandonnée dans les cosmétiques modernes.
Effets sur la santé
L'hydroxyde de sodium réagit violemment avec l'eau en quantité appréciable uniquement, risquant ainsi de provoquer des éclaboussures dangereuses. Quand il est mélangé avec de l'eau, la température du mélange augmente jusqu'à atteindre une température proche de celle du point d'ébullition de l'eau, soit 100 °C. La soude caustique est irritante et corrosive pour la peau, les yeux, les voies respiratoires et digestives. Elle doit être manipulée avec des gants, des lunettes de protection et une protection des voies respiratoires. En cas de contact avec la peau, rincez abondamment avec de l'eau[11] et consultez un médecin. En cas d'ingestion accidentelle, il ne faut pas faire vomir à cause du risque de double brulure (aller et retour). Boire des acides (jus de citron, d'oranges, de kiwis etc... ) pour contrer les effet de la base sur les parois de l'estomac et en particulier boire abondamment (+ d'un litre par quart d'heures) de l'eau la plus froide envisageable pour limiter la corrosion et une élévation trop brutale de la température des parois de l'estomac, cela aura aussi pour effet de limiter la corrosion des parois de l'œsophage. Enfin appelez les secours le plus vite envisageable. En cas de contact avec les yeux il faut rincer abondamment pendant au moins 20 minutes sous l'eau courante, si vous avez des kits de neutralisation des bases, il est fortement recommandé de les utiliser, et ensuite consulter un médecin ophtalmologiste[11].
Effets sur l'environnement
La soude caustique augmente le pH des cours d'eau, représentant ainsi une menace potentielle pour la faune et la flore aquatique.
La soude caustique ne doit pas être confondue avec le bicarbonate de sodium, ni avec le carbonate de sodium.
La soude caustique s'infiltre dans la terre, peut nuire a l'agriculture comme à l'environnement des végétaux, des minéraux et des animaux proches ou lointains (rivière, fleuve, nappe phréatique).
Notes et références
- HYDROXIDE DE SODIUM, fiche de sécurité du Programme International sur la Sécurité des Substances Chimiques, consultée le 9 mai 2009
- Masse molaire calculée selon Atomic weights of the elements 2007 sur www. chem. qmul. ac. uk
- (en) David R. Lide, CRC Handbook of Chemistry and Physics, CRC Press Inc, 2009, 90e éd. , Relié, 2804 p. (ISBN 978-1-420-09084-0)
- ESIS. Consulté le 6 décembre 2008
- «Hydroxyde de sodium» dans la base de données de produits chimiques Reptox de la CSST (organisme québécois responsable de la sécurité et de la santé au travail), consulté le 25 avril 2009
- Numéro index dans le tableau 3.1 de l'annexe VI du règlement CE N° 1272/2008 (16 décembre 2008)
- (en) [pdf] FAO Monograph 1 (2006) SODIUM HYDROXIDE INS number : 524
- Parlement européen et Conseil de l'Europe, «La Directive 95/2/CE concernant les additifs alimentaires autres que les colorants et les édulcorants», dans Journal officiel de l'Union européenne, no L 61, 20/02/1995, p. 1-56 [ texte intégral (page consultée le 19/05/2008) ]. [pdf]
- Noms de catégorie et dispositif international de numérotation des additifs alimentaires, CAC/GL 361989 sur http ://www. codexalimentarius. net, Codex alimentarius, 1989, p. 1-35. Consulté le 14/09/2008. [pdf]
- (en) Codex Alimentarius Commission, «Updated up to the 31st Session of the Codex Alimentarius Commission for Sodium hydroxide (524) », GSFA Online sur http ://www. codexalimentarius. net, Codex Alimentarius, 2008. Consulté le 3/10/2008.
- Fiche CSST, premiers secours
Voir aussi
Liens externes
Recherche sur Amazone (livres) : |
Voir la liste des contributeurs.
La version présentée ici à été extraite depuis cette source le 30/11/2010.
Ce texte est disponible sous les termes de la licence de documentation libre GNU (GFDL).
La liste des définitions proposées en tête de page est une sélection parmi les résultats obtenus à l'aide de la commande "define:" de Google.
Cette page fait partie du projet Wikibis.



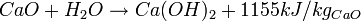

 Accueil
Accueil Recherche
Recherche Début page
Début page Contact
Contact Imprimer
Imprimer Accessibilité
Accessibilité