Nitrate d'argent
Le nitrate d'argent a pour formule brute : Ag N O 3

Catégories :
Composé de l'argent - Produit chimique corrosif - Produit chimique dangereux pour l'environnement - Produit chimique comburant - Nitrate - Goût astringent
|
Recherche sur Google Images :
Source image : disactis.com Cette image est un résultat de recherche de Google Image. Elle est peut-être réduite par rapport à l'originale et/ou protégée par des droits d'auteur. |
Page(s) en rapport avec ce sujet :
- Le principe de l'opération réside simplement dans le fait que le nitrate d'argent est soluble dans l'eau, tandis que le nitrate de cuivre (quand il a été... (source : alchimie-pratique)
- ... Tu dissous queloques grains de nitrate d'argent dans de l'eau distillée.... Ce nitrate d'argent est un produit particulièrement tachant, et tachant le lendemain.... (source : forums.futura-sciences)
- Le nitrate d'argent est soluble dans : - un même poids d'eau froide, . - son demi -poids d'eau bouillante. - 10 fois son poids d'alcool froid... (source : fred.elie.free)
| Nitrate d'argent | |||
|---|---|---|---|
 |
|||
| Général | |||
| Synonymes | nitrate d'argent (I) | ||
| No CAS | |||
| No EINECS | |||
| Code ATC | D08 | ||
| SMILES |
|
||
| InChI |
|
||
| Apparence | cristaux inodores, incolores transparents ou blancs. [1] | ||
| Propriétés chimiques | |||
| Formule brute | AgNO3 [Isomères] |
||
| Masse molaire[2] | 169, 8731 ± 0, 0013 g·mol-1 Ag 63, 5 %, N 8, 25 %, O 28, 26 %, |
||
| Propriétés physiques | |||
| T° fusion | 212 °C[1] | ||
| T° ébullition | Se décompose au-dessous du point d'ébullition à 444 °C[1] | ||
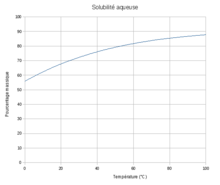
| Solubilité | 35 g·l-1 (méthanol) 2, 2 g·l-1 (benzène) [3] |
||
| Masse volumique | 4, 352 g·cm-3 [3] | ||
| Précautions | |||
|
|
|||
|
|||
|
|
|||
| Phrases R : 34, 50/53, | |||
| Phrases S : (1/2), 26, 45, 60, 61, | |||
|
|
|||
|
|||
|
|
|||
  |
|||
|
|
|||
  Danger |
|||
| Peau | irritant | ||
| Ingestion | gastro-entérite mortelle | ||
| Autres infos | toxique | ||
|
|
|||
Le nitrate d'argent a pour formule brute : AgNO3
Chimie
L'équation de sa dissolution dans l'eau est : AgNO3 → Ag+ (aq) + NO3- (aq)
Il est surtout utilisé dans le réactif de Tollens pour des tests de reconnaissance des aldéhydes.
Il est aussi utilisé pour identifier les ions chlorure Cl- (Il se forme un précipité blanc qui noircit à la lumière).
Les solutions de nitrate d'argent donnent de l'argent métallique au contact de la lumière. En cas de taches faites à partir de nitrate d'argent (sur les vêtements, les sols... ), l'unique moyen de les nettoyer est de laisser agir quelques minutes une solution saturée de ferricyanure de potassium (cette solution jaune-rouge ne fixe pas les tissus) on observe alors un léger changement de couleur des taches dû à la formation de ferricyanure d'argent soluble dans l'eau.
Autre utilisations
C'est un antiseptique externe, fonction caustique. Il est utilisé dilué dans les solutions oculaires.
Le nitrate et les halogénures d'argent — bromure, chlorure et iodure d'argent noircissent après exposition à la lumière : ils sont employés dans les émulsions pour les plaques, le film et le papier photographiques. Leurs sels sont solubles dans le thiosulfate de sodium, composé utilisé dans le procédé de fixation photographique.
Il est d'autre part utilisé dans le placage à l'argent (argenture), la fabrication de miroirs, les encres inaltérables et les encres invisibles, la coloration de la porcelaine et la teinture des cheveux.
Notes et références de l'article
- NITRATE D'ARGENT, fiche de sécurité du Programme International sur la Sécurité des Substances Chimiques, consultée le 9 mai 2009
- Masse molaire calculée selon Atomic weights of the elements 2007 sur www. chem. qmul. ac. uk
- (en) Ullmann's Encyclopedia of Industrial Chemistry, Release 2004, 7th Edition, Silver, Silver Compounds, and Silver Alloys, Wiley-VCH Verlag GmbH & Co, 2001 DOI :10.1002/14356007. a24_107
- «Nitrate d'argent» dans la base de données de produits chimiques Reptox de la CSST (organisme québécois responsable de la sécurité et de la santé au travail), consulté le 25 avril 2009
- Numéro index dans le tableau 3.1 de l'annexe VI du règlement CE N° 1272/2008 (16 décembre 2008)
Voir aussi
Liens et documents externes
Recherche sur Amazone (livres) : |
Voir la liste des contributeurs.
La version présentée ici à été extraite depuis cette source le 30/11/2010.
Ce texte est disponible sous les termes de la licence de documentation libre GNU (GFDL).
La liste des définitions proposées en tête de page est une sélection parmi les résultats obtenus à l'aide de la commande "define:" de Google.
Cette page fait partie du projet Wikibis.



 Accueil
Accueil Recherche
Recherche Début page
Début page Contact
Contact Imprimer
Imprimer Accessibilité
Accessibilité