Citrate de sodium
Le citrate de sodium peut être obtenu par un mélange de soude et d'acide citrique. C'est un additif alimentaire, E331, qui est parfois utilisé comme régulateur de l'acidité, séquestrant, émulsifiant ou stabilisant.

Catégories :
Composé du sodium - Citrate - Régulateur alimentaire de pH - Séquestrant - Agent chélatant - Chélation - Chimie analytique
Recherche sur Google Images :
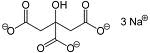
Source image : fr.academic.ru Cette image est un résultat de recherche de Google Image. Elle est peut-être réduite par rapport à l'originale et/ou protégée par des droits d'auteur. |
Page(s) en rapport avec ce sujet :
- Fiche de Données de Sécurité. Selon Règlement (CE) 1907/2006 tri- Sodium Citrate 2-hydrate. 1. Identification de la substance/préparation et de la société/... (source : laurylab)
- Sodium citrate. Liste des médicaments contenant la substance : Sodium citrate.... MELOXICAM BIOGARAN 15 mg cp séc · MELOXICAM BIOGARAN 7, 5 mg cp... (source : vidal)
- a b c CITRATE DE SODIUM, ANHYDRE, fiche de sécurité du Programme International sur la Sécurité des Substances Chimiques, consultée le 9 mai 2009... (source : dictionnaire.sensagent)
| Citrate de sodium | |
|---|---|
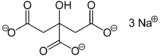 |
|
| Général | |
| Synonymes | Citrate de trisodium |
| No CAS | (anhydre) (dihydrate) (pentahydrate) |
| No EINECS | |
| No E | E331 (iii) |
| FEMA | |
| SMILES |
|
| InChI |
|
| Apparence | poudre blanche ou granulés. (anhydre) [1] |
| Propriétés chimiques | |
| Formule brute | C6H5Na3O7 [Isomères] |
| Masse molaire[2] | 258, 069 ± 0, 0073 g·mol-1 C 27, 92 %, H 1, 95 %, Na 26, 73 %, O 43, 4 %, |
| Propriétés physiques | |
| T° fusion | >300 °C (anhydre) [1], 150 °C (dihydrate, décomposition) [3] |
| Solubilité | dans l'eau à 25 °C : 425 g·l-1 (anhydre) [1], dans l'eau : 770 g·l-1 (dihydrate) [3] dans l'eau : bonne (pentahydrate) [4] |
| Précautions | |
|
|
|
|
|
|
| Phrases S : 25, | |
|
|
|
| Produit non contrôlé | |
|
|
|
Le citrate de sodium peut être obtenu par un mélange de soude et d'acide citrique. C'est un additif alimentaire, E331 (iii) [6], qui est parfois utilisé comme régulateur de l'acidité, séquestrant, émulsifiant ou stabilisant[7].
Références
- CITRATE DE SODIUM, ANHYDRE, fiche de sécurité du Programme International sur la Sécurité des Substances Chimiques, consultée le 9 mai 2009
- Masse molaire calculée selon Atomic weights of the elements 2007 sur www. chem. qmul. ac. uk
- CITRATE DE SODIUM DIHYDRATE, fiche de sécurité du Programme International sur la Sécurité des Substances Chimiques, consultée le 9 mai 2009
- CITRATE DE SODIUM PENTAHYDRATE, fiche de sécurité du Programme International sur la Sécurité des Substances Chimiques, consultée le 9 mai 2009
- «Citrate de sodium anhydre» dans la base de données de produits chimiques Reptox de la CSST (organisme québécois responsable de la sécurité et de la santé au travail), consulté le 25 avril 2009
- Parlement européen et Conseil de l'europe, «Directive 95/2/CE concernant les additifs alimentaires autres que les colorants et les édulcorants», dans Journal officiel, no L 61, mars 1995, p. 1-56 [ texte intégral (page consultée le 27/06/2008. ) ]
- Noms de catégorie et dispositif international de numérotation des additifs alimentaires, CAC/GL 361989 sur www. codexalimentarius. net, Codex Alimentarius, 1989, p. 1-35. Consulté le 14/09/2008.
Recherche sur Amazone (livres) : |
Principaux mots-clés de cette page :
citrate - sécurité - sodium - anhydre - chimiques - dihydrate - international - consultée - 2009 - pentahydrate - eau - additif - alimentaire - fiche - programme - substances - e331 - iii - propriétés - masse -
Ce texte est issu de l'encyclopédie Wikipedia. Vous pouvez consulter sa version originale dans cette encyclopédie à l'adresse http://fr.wikipedia.org/wiki/Citrate_de_sodium.
Voir la liste des contributeurs.
La version présentée ici à été extraite depuis cette source le 30/11/2010.
Ce texte est disponible sous les termes de la licence de documentation libre GNU (GFDL).
La liste des définitions proposées en tête de page est une sélection parmi les résultats obtenus à l'aide de la commande "define:" de Google.
Cette page fait partie du projet Wikibis.
Voir la liste des contributeurs.
La version présentée ici à été extraite depuis cette source le 30/11/2010.
Ce texte est disponible sous les termes de la licence de documentation libre GNU (GFDL).
La liste des définitions proposées en tête de page est une sélection parmi les résultats obtenus à l'aide de la commande "define:" de Google.
Cette page fait partie du projet Wikibis.

 Accueil
Accueil Recherche
Recherche Début page
Début page Contact
Contact Imprimer
Imprimer Accessibilité
Accessibilité