EDTA
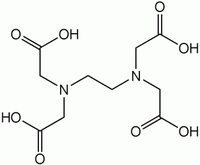
L'EDTA est le sigle de l'acide éthylène diamine tétra acétique. La formule chimique de cet acide diaminotétracarboxylique est C 10 H 16 N 2 O 8 de masse molaire 292,24264 g mol -1.

Catégories :
Produit chimique irritant - Sigle de 4 caractères - Acide aminé - Diamine - Agent conservateur - Agent chélatant - Chélation - Chimie analytique - Séquestrant - Antidote
Recherche sur Google Images :

Source image : french.alibaba.com Cette image est un résultat de recherche de Google Image. Elle est peut-être réduite par rapport à l'originale et/ou protégée par des droits d'auteur. |
Page(s) en rapport avec ce sujet :
- Acide éthylène diamine tétra acétique (EDTA) : désignez les coordonnées importantes... Conditionneur de produits chimiques. Nous travaillons en France.... (source : entreprises.kompass)
- EDTA. Nom chimique : Sel disodique MF d'acide éthylènediaminetétracétique : C10H14N2Na2O8. MW : 336.21. cn. China (Mainland). Contacter immédiatement... (source : french.alibaba)
- Produits chimiques Acide Acide EDTA Acide éthylène diamine tétra- acétique sel disodique solution titrée en ampoule Syn : EDTA disodique / titriplex III... (source : grosseron)
| EDTA | ||
|---|---|---|
 |
||
| Général | ||
| Nom IUPAC | acide éthylène- diamine-tétraacétique |
|
| Synonymes | Acide édétique[1] | |
| No CAS | ||
| No EINECS | ||
| No E | E385 (Ca, Na) E386 (Na) |
|
| SMILES |
|
|
| InChI |
|
|
| Apparence | solide incolore à blanc, inodore [2] | |
| Propriétés chimiques | ||
| Formule brute | C10H16N2O8 [Isomères] |
|
| Masse molaire[3] | 292, 2426 ± 0, 0119 g·mol-1 C 41, 1 %, H 5, 52 %, N 9, 59 %, O 43, 8 %, |
|
| Propriétés physiques | ||
| T° fusion | 245 °C (décomposition) [4] | |
| Solubilité | 1 g·l-1 (eau, 25 °C) [4] 400 mg·l-1 (eau, 20 °C) [2] |
|
| Masse volumique | 0, 86 g·cm-3 (20 °C) [2] | |
| T° d'auto-inflammation | > 200 °C [2] | |
| Point d'éclair | > 100 °C [2] | |
| Pression de vapeur saturante | < 0, 013 mbar (20 °C) [2] | |
| Précautions | ||
|
|
||
|
||
|
|
||
| Phrases R : 36, | ||
| Phrases S : 2, 26, [5] | ||
|
|
||
 |
||
| Écotoxicologie | ||
| DL50 | 30 mg·kg-1 (souris, oral) 28, 5 mg·kg-1 (souris, i. v. ) 250 mg·kg-1 (souris, i. p. ) [4] |
|
|
|
||
L'EDTA est le sigle de l'acide éthylène diamine tétra acétique. La formule chimique de cet acide diaminotétracarboxylique est C10H16N2O8 de masse molaire 292, 24264 g mol-1.
L'EDTA comporte 6 sites basiques, 4 correspondant aux bases conjuguées (carboxylates) des fonctions carboxyliques et 2 correspondant aux fonctions amines.
Sa principale caractéristique est son fort pouvoir chélatant (ou complexant) par lequel il forme des complexes métalliques particulièrement stables, ce qui en fait un poison. Dans les complexes, l'EDTA est lié aux cations métalliques sous la forme d'une de ses bases conjuguées.
Applications
Il est susceptible d'être utilisé dans de nombreuses applications, par exemple dans l'industrie du papier, la photographie ou les industries de l'hygiène et l'alimentaire (antioxygène, agent de conservation et séquestrant E385[7]). À cause de sa toxicité, la concentration est bien entendu adaptée à l'usage. L'EDTA est utilisé pour traiter des eaux (par exemple dans les lessives), pour éviter les précipitations (entartrage).
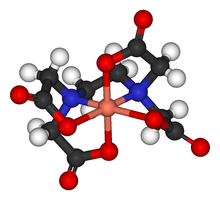
- En chimie et papeterie, l'EDTA est utilisé pour doser par complexométrie les ions métalliques en solution (TH).
- En biochimie, l'EDTA est utilisé comme inhibiteur des métallo-enzymes. Son utilisation est particulièrement fréquente dans la purification des acides nucléiques (ADN ou ARN) et des protéines (voir tampon TÆ et tampon TBE). En séquestrant surtout les ions magnésium Mg2+, il bloque l'activité de nombreuses nucléases qui sont dépendantes de cet ion. L'EDTA est aussi un inhibiteur des métalloprotéases à zinc et limite ainsi l'hydrolyse des protéines dans les extraits cellulaires. En génie biologique, l'EDTA est utilisé en routine pour stopper l'activité de polymérases, la chélation des ions calcium modifiant la conformation des enzymes.
- En médecine, l'EDTA, en formant des chélates ferriques (du fer (III) ), sert à lutter contre les surcharges tissulaires en fer (hypersidéroses). L'EDTA est utilisé aussi dans les intoxications par métaux lourds. Il est aussi utilisé comme conservateur dans les collyres, en conjonction avec d'autres conservateurs tels que le thiomersal ou le chlorure de benzalkonium[8]. L'EDTA est aussi utilisé comme anticoagulant, surtout dans les tubes de sang, dans la mesure où il capte les ions Ca2+ qui sont un facteur important de la coagulation.
- En agronomie, l'EDTA est un chélateur capable de faire rentrer certains éléments nutritifs dans la plante. Un ajout d'EDTA dans un sol sert à lutter contre les carences en oligo-éléments.
- Dans le domaine de l'agroalimentaire et de la cosmétique, l'EDTA est utilisé comme stabilisateur de produit vis-à-vis de la dégradation par les bactéries (fermentation). Comme les complexes métalliques de l'EDTA sont nettement plus stables que ceux dérivés de ligands protéiques, les cations métalliques deviennent indisponibles pour les micro-organismes pour lesquels ils sont essentiels, d'où une inhibition de la croissance bactérienne.
Notes et références
- ACIDE EDETIQUE, fiche de sécurité du Programme International sur la Sécurité des Substances Chimiques, consultée le 9 mai 2009
- Entrée du numéro CAS «60-00-4» dans la base de données de produits chimiques GESTIS de la BGIA (organisme allemand responsable de la sécurité et de la santé au travail) (allemand, anglais), accès le 13 février 2009 (JavaScript indispensable)
- Masse molaire calculée selon Atomic weights of the elements 2007 sur www. chem. qmul. ac. uk
- (en) «Edetic acid» sur ChemIDplus, consulté le 13 février 2009
- «acide edetique» sur ESIS, consulté le 13 février 2009
- «Acide éthylènediaminetétraacétique» dans la base de données de produits chimiques Reptox de la CSST (organisme québécois responsable de la sécurité et de la santé au travail), consulté le 25 avril 2009
- [pdf] Codex Alimentarius (1989) Noms de catégorie et dispositif international de numérotation des additifs alimentaires. CAC/GL 36-1989, p1-35.
- Drs. Patrice Vo Tan & Yves Lachkar, Les conservateurs en ophtalmologie, Librairie Médicale Théa
Recherche sur Amazone (livres) : |
Voir la liste des contributeurs.
La version présentée ici à été extraite depuis cette source le 30/11/2010.
Ce texte est disponible sous les termes de la licence de documentation libre GNU (GFDL).
La liste des définitions proposées en tête de page est une sélection parmi les résultats obtenus à l'aide de la commande "define:" de Google.
Cette page fait partie du projet Wikibis.


 Accueil
Accueil Recherche
Recherche Début page
Début page Contact
Contact Imprimer
Imprimer Accessibilité
Accessibilité