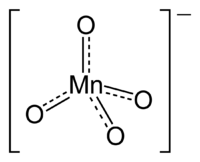
Permanganate
Le permanganate est l'anion des sels de l'acide permanganique. On parle fréquemment de permanganate pour désigner le permanganate de potassium.
Recherche sur Google Images :

Source image : paperblog.fr Cette image est un résultat de recherche de Google Image. Elle est peut-être réduite par rapport à l'originale et/ou protégée par des droits d'auteur. |
Page(s) en rapport avec ce sujet :
- Dans la réaction étudiée seule l'ion permanganate est coloré. pour choisir cette... Quelle est la couleur de l'ion permanganate en solution aqueuse ?.... [ MnO 4 - ]t=0 dans le mélange avant que la réaction ne débute : 10-5 / ( (10+10)... (source : chimix)
- Dans neutre la solution, permanganate est uniquement réduite par 3e− pour donner MnO 2, où le manganèse est dans un état de l'oxydation +4.... (source : worldlingo)
Le permanganate (MnO4-) est l'anion des sels de l'acide permanganique. On parle fréquemment de permanganate pour désigner le permanganate de potassium.
Les permanganates sont surtout utilisés pour la synthèse de produits chimiques, en chimie analytique — titrations volumétriques par oxydo-réduction, telles l'oxydabilité ou le dosage de l'acide oxalique — et en médecine — pour désinfecter. Le contre-ion est le plus souvent le potassium. Le permanganate de potassium (KMnO4) s'utilise en solution diluée (environ au millième) pour l'antisepsie en dermatologie ou en gynécologie ainsi qu'en aquaculture ou en aquariophilie.
Propriétés physico-chimiques (Permanganate de potassium :KMnO4)
- Composition élémentaire : 24, 74 % K + 34, 76 % Mn + 40, 50 % O ;
- Masse molaire : 158, 04 g/mol ;
- État (TPN) : solide ;
- Couleur : violet ;
- Odeur : sans ;
- Hydrosolubilité : soluble dans 14 parties d'eau froide ou 3, 5 parties d'eau bouillante ;
- Classe de toxicité : nocif (DL50 d'environ 500 mg·kg-1 pour la souris).
Propriétés oxydantes
Ses propriétés désinfectantes résultent du fait que le manganèse y est à son degré d'oxydation le plus élevé (+VII). Comme l'hypochlorite, les permanganates sont par conséquent de puissants oxydants :
- (1) MnO4- (aq) + 4 H+ + 3 e- ↔ MnO2 (s) + 2 H2O : Eo = 1, 69 V
- (2) MnO4- (aq) + 8 H+ + 5 e- ↔ Mn2+ (aq) + 4 H2O : Eo = 1, 51 V
En présence de matière organique ou de réducteurs, il existe par conséquent un risque d'explosion, que le permanganate soit à l'état solide ou en solution.
Le permanganate de potassium est utilisé comme désinfectant pour l'eczéma suintant, dilué à 1/10000. Il convient de le tamponner et de l'utiliser pour le nettoyage minimum 3 fois/jour. Au contact de la plaie, il devient terne et perd sa couleur mauve, signe qu'il a réagi. Il assèche les lésion et diminue les démangeaisons.
Le permanganate est particulièrement utilisé lors des dosages, car ses propriétés oxydantes lui permettent d'oxyder nombre d'espèces chimiques. Cependant, afin d'assurer la précision de ceux-ci, il est bon de savoir que certaines réactions «parasites» peuvent intervenir : Le permanganate en solution aqueuse oxyde l'eau en dioxygène. Quoique cette réaction soit particulièrement lente, elle peut changer le titre de la solution.
De plus, on place toujours le permanganate dans la burette (et non dans le bécher) car le produit de la réaction (2), à savoir Mn2+, peut réagir avec le permanganate non réduit selon :
- 2MnO4- (aq) + 3 Mn2+ (aq) + 2 H2O ↔ 5 MnO2 (s) + 4 H+
Cette réaction est à l'origine du précipité brunâtre observé dans les solutions de permanganate "agées" ou si on mêle légèrement de réducteur à une solution de permanganate.
Notes et références
Recherche sur Amazone (livres) : |
Voir la liste des contributeurs.
La version présentée ici à été extraite depuis cette source le 30/11/2010.
Ce texte est disponible sous les termes de la licence de documentation libre GNU (GFDL).
La liste des définitions proposées en tête de page est une sélection parmi les résultats obtenus à l'aide de la commande "define:" de Google.
Cette page fait partie du projet Wikibis.


 Accueil
Accueil Recherche
Recherche Début page
Début page Contact
Contact Imprimer
Imprimer Accessibilité
Accessibilité